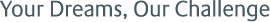新型コロナのワクチン開発・量産にも貢献 製薬業界で世界的存在感を放つAGCのCDMO事業
- #ライフサイエンス
世界中の人々の暮らしと社会活動を一変させた新型コロナウイルス感染症(COVID-19)。その拡大阻止に向けて、世界中の医療機関や製薬業界に携わる人々が一丸となり、未曾有の危機に挑んでいる。医薬品の製造や製造プロセス技術の開発を受託・代行するCDMOビジネスを営むAGCもまた、ワクチン開発の支援と原材料の量産を担い、終息に向けて取り組んでいる。現在の製薬業界では、新しい医療技術を迅速、かつ広く世界中の人々に届けるため、CDMOは欠かせない存在になった。世界有数のCDMOとなったAGCの役割、今後の事業展開を紹介する。
Profile

小室 則之
執行役員 化学品カンパニー ライフサイエンス事業本部長

高見 潤
化学品カンパニー ライフサイエンス事業本部 AGCバイオロジクス 日本サイトヘッド

竹澤 健一
化学品カンパニー ライフサイエンス事業本部 AGCバイオロジクス 日本サイト Quality ヘッド
2021年に入り、ワクチン接種が進んだ国や地域では新型コロナウイルス感染症の爆発的拡大はストップ。都市封鎖状態を脱し、正常な生活を取り戻してウイルスと共存する「ウィズコロナ」の段階に入った。通常ならば数年かかるワクチンの開発を、わずか1年足らずで大量接種を実施するまでに至ったのは、まさに人類の英知と努力による歴史的成果だと言えよう。このように迅速な開発・量産が進まなかったとしたら、今、世界はどのような状態になっていたのだろうか。想像しただけで背筋が凍る思いだ。
早期のワクチン開発・量産は、ファイザー社/ビオンテック社やモデルナ社などが、メッセンジャーRNA(mRNA)を活用するなど最新バイオ技術を駆使して開発をリード。いち早く集団接種が可能な状態にこぎつけた。ただし、ワクチンの実用化に尽力したのは、こうした製薬会社だけでない。集団接種に向け、製薬に関わる世界中の研究機関や企業が、それぞれの持ち場でワクチンの実現・量産・供給の実現を目指した。日本の製薬業界も同様だ。直接ワクチン開発に携わるところだけでなく、開発を支援する企業、量産体制を整える企業などが粛々と準備を進めていた。
医薬品の製造や製造プロセス技術の開発を受託・代行するCDMO(Contract Development and Manufacturing Organization)ビジネスを営むAGCも、そんな企業の一つだ(図1)。コロナ禍終息への道のりは未だ長い。ワクチンが行き届いていない国や地域は少なくなく、変異ウイルス拡大の恐れもある。AGCをはじめとする多くの製薬関連の研究機関や企業は、現在も取り組みの手綱を緩めていない。

図1 医薬品の開発・製造を製薬会社から請け負うCDMOビジネスを営むAGC (左)AGCのCDMOビジネスの強み (右)主力拠点である千葉工場
AGCは新型コロナウイルスのワクチンの開発・製造に、様々な側面から関与してきた。代表的な取り組みを追うと、2021年6月8日にはドイツのBioNTech社から、日本でも地域接種に使われた「Pfizer-BioNTech COVID-19ワクチン(注1)」の原材料であるプラスミドDNA(注2)の製造受託を発表した。それ以前にも、2020年6月4日にノババックス社が開発したワクチン候補「NVX-CoV2373」のアジュバント(注3)の生産受託を、同年8月18日にはその受託規模が約1.5倍に拡大したことを発表している。このワクチンは武田薬品工業が製造・流通を受託して、日本政府と1億5000万回分のワクチン供給計画を結んだことが発表された。2022年には日本でも承認される見込みである。
(注1)ビオンテックが所有するmRNAワクチン技術に基づくワクチンであり、ビオンテックとファイザーにより共同開発された。ビオンテックは、EUにおける製造販売承認、ならびに米国(ファイザーと共同)、英国、カナダなどの国において計画している製造販売承認申請に先立つ緊急使用許可または同等の許可などを有している。
(注2)プラスミドDNAとは、目的遺伝子を細胞内に運ぶために使用されるDNA。mRNA製造にも用いられる。
(注3)アジュバントとは、薬の効果を高めたり、補助したりする目的で併用される物質・成分の総称。
医薬品の製造プロセス技術の開発とGMPグレード(注4)での量産を担える専門企業、CDMOがなければ「これほど早く、世界中の人々にワクチンを届けることはできなかったかもしれません。ワクチンを開発した企業が量産プラントを作り、運用するには、相応の資金と期間、知見やスキルが必要になるからです」と執行役員 化学品カンパニー ライフサイエンス事業本部長の小室則之氏は言う。特に、ワクチン開発をリードしていた企業にはベンチャーも多く、たとえワクチン開発に成功しても、⾃前で迅速に量産することはほぼ不可能だったはずだ。CDMOには、既にワクチンの量産に必要な設備が用意され、量産立ち上げに携わる訓練された人材もいる。このためワクチン開発に成功すれば、いつでも量産を開始できる状態にあったのだ。
(注4)GMP(Good Manufacturing Practice)とは 治験薬の品質を保証するために、製造時に遵守すべきガイドライン。

執行役員 化学品カンパニー ライフサイエンス事業本部長 小室 則之氏
合成医薬品やバイオ医薬品を受託開発・製造するCDMOとはどのようなビジネスなのか。ピンとこない人もいるかもしれない。そこでまず、CDMOの役割とその将来性について触れておきたい。
かつては製薬会社が、薬効のある新物質を開発する創薬から、臨床での治験、さらには大量製造に向けたプロセス技術開発、量産まで自社で行うことが多かった。ところが近年、新たな医薬品を市場に送り出すまでの、創薬や治験、量産とそれぞれの工程に民間企業が扱うには巨額すぎるほどの投資が必要になった。このためすべてを自社内で行うと、失敗すれば企業が一発破綻するほどのリスクを抱えかねない状況になってきた。そこで多くの製薬会社が、特に膨大な資金が必要な創薬に徹し、治験や量産を外部企業に委託する水平分業化が進んできた。こうした文脈の中で登場したのが、AGCのようなCDMOである。
現在、製造業の水平分業化は、あらゆる業界で進んでいる。そして、CDMOのような開発や製造を受託する企業の役割と業界内での存在感は極めて大きい。例えば、電子産業では台湾の鴻海精密工業社などEMS(電子製品受託製造)が、様々なブランドのスマートフォンやゲーム機などを受託して一括生産していることをご存じの方は多いだろう。半導体の分野でもTSMC社というファウンドリーが、競合関係にある半導体メーカーのチップであっても1社で受託生産している。特筆できることは、CDMOを含むこうした受託企業は単なる下請けではなく、発注している企業以上の存在感を放つようになったことだ。半導体の分野で、TSMC社が欧米や日本の政府から工場誘致の熱いラブコールを受ける存在になっていることは、水平分業型の業界内における受託専業企業の存在感の大きさを雄弁に物語っている。
CDMOの仕事には、薬効成分を持つ原薬の開発・生産を請け負うものと、原薬に様々な成分を混ぜて錠剤やカプセル、注射液など使いやすい形に仕上げる工程の開発・生産を請け負うものがある。このうちAGCは、原薬の開発・生産を請け負うCDMOビジネスに特化。医薬品原料のCDMOの市場は、2020年から2024年にかけて合成医薬品では年平均7%、従来型バイオ医薬品(微生物・動物)では10%、遺伝子細胞治療薬では31%での成長が見込まれている(図2)。
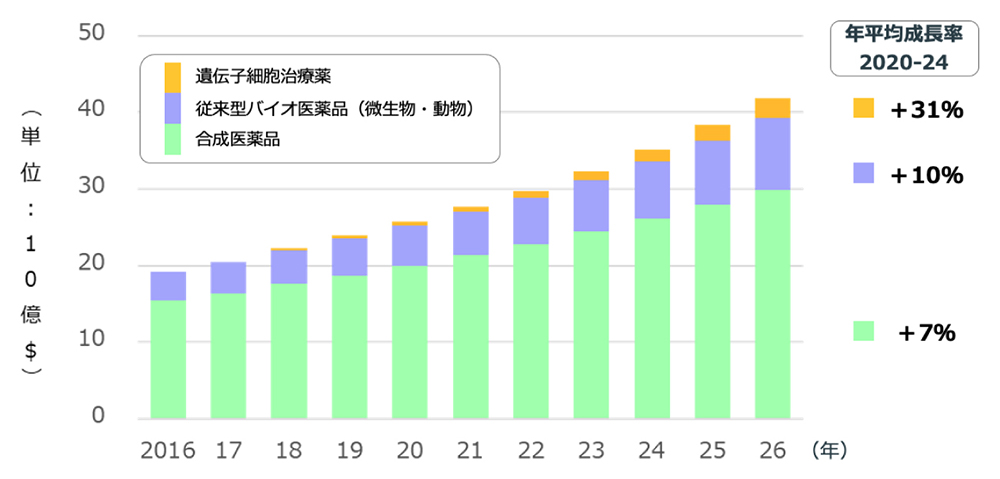
図2 医薬品原薬CDMOの市場規模の推移
出典:Evaluate Pharma® World Preview 2017,Outlook to 2022などを基にAGCが推定
ガラスに代表される素材の会社であるAGCが、いかなる経緯で医薬品を開発・製造するビジネスを始めたのか。疑問に感じる人も多いだろう。実は、AGCの化学品ビジネスとCDMOなどライフサイエンス・ビジネスは、技術開発の系譜に着目すれば一本でつながっているのだ(図3)。
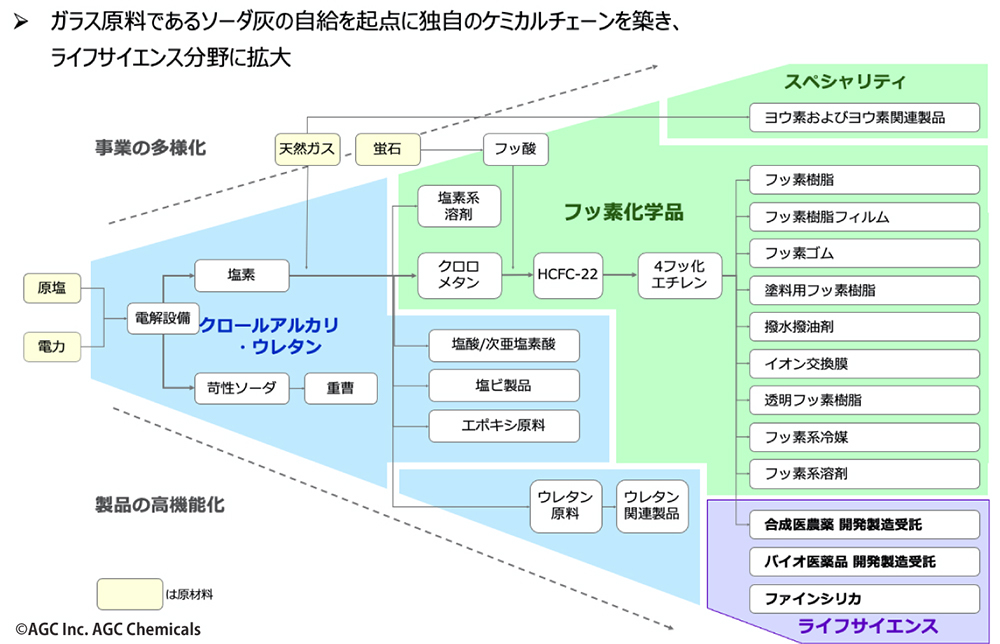
図3 AGCでの化学品からライフサイエンスへの技術開発の系譜
AGCの化学品事業は今からおよそ100年前、板ガラスの原料であるソーダ灰を自給することから始まった。現在では、塩水の電気分解から始まるケミカルチェーンを起点として、苛性ソーダや塩素製品などライフラインを支えている基礎化学品から、フッ素樹脂製品など耐久性に優れニッチな分野で機能を発揮している高機能化学品まで、枝葉のように製品を展開している。
「ライフサイエンスチーム」が発足したのは1973年。⾃社のフッ素化技術の医薬・農薬への応⽤可能性を検討するため、この分野に足を踏み入れた。1985年には、製薬会社向けに抗菌材用フッ素中間体の受託製造と供給を開始し、合成医農薬のCDMOビジネスを開始した。その後、2003年には千葉工場内に本格的なGMP対応の多用途向けプラントを建て、合成医農薬の量産体制を整備。2008年には緑内障治療薬原体「タフルプロスト」の製造販売の承認を取得し、着実に実績を積んでいった。さらには、スペインの合成医薬品原薬の製造工場を買収し、グローバル市場でCDMOビジネスを展開できる体制を整えていった。
加えて、CDMOビジネスを開始した1年前の1994年には、中央研究所内に医薬品開発へフォーカスする「バイオケミカルグループ」を設置。2000年には、たんぱく質の受託製造事業に本格参入し、バイオ医薬品のCDMOビジネスも開始した。2008年には千葉工場にバイオ受託プラントを建てて生産能力を10倍に高める新プラントを建設し、バイオ医薬品の量産体制の整備を進めた。
2016年以降、AGCは毎年のようにM&Aや製薬会社の工場の買収を実施。買収した拠点では、逐次、生産体制の増強も進めている。これにより、グローバルな開発・製造体制を確立した。日本を主要拠点とする数少ないグローバル展開CDMOとして、欧米を含めた3極で、治験から商用までに向けた化学合成、微生物、動物細胞、遺伝子細胞治療の医薬における高レベルのcGMP(注5)生産体制を整えている(図4)。
(注5)cGMP(現行医薬品適性製造基準)とは、医薬品が同じ規格で製造され、ロット全体、また経時的に同じ性能を示せることを保証するための基準。
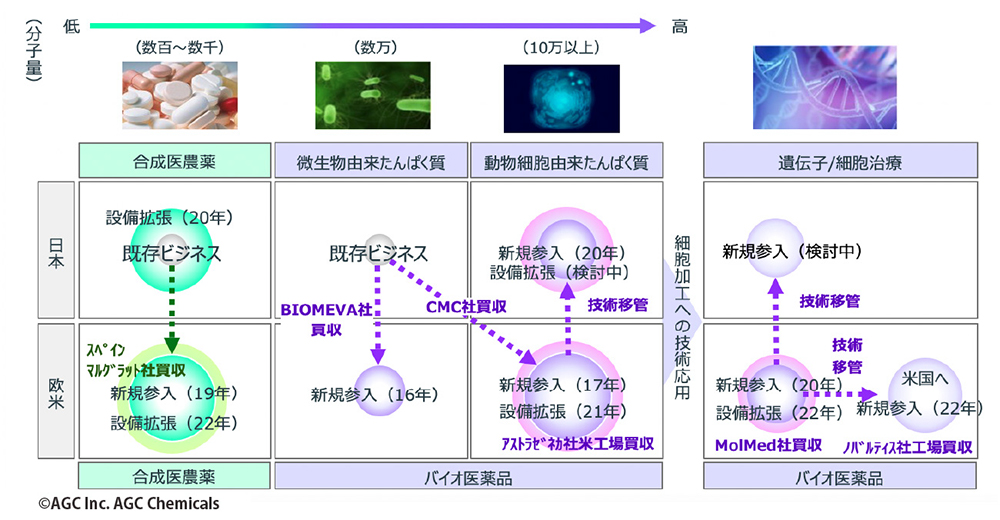
図4 AGCのCDMOビジネスの概要
バイオ医薬品の分野では、2016年に微生物を活用したバイオ医薬品やプラスミドDNAの分野で実績を持つドイツのバイオ系CDMOバイオミーバ社を買収したのを皮切りに、2017年には欧米に製造拠点を持つデンマークのCMCバイオロジクス社を買収。2020年にはアストラゼネカ社が保有していた米国コロラド州ボルダーのバイオ医薬品工場を取得した。さらには遺伝子・細胞治療の分野で豊富な実績を持ちミラノに2拠点を保有していたイタリアのMolMed社を買収し、2021年には米Novartis Gene Therapies社からコロラド州ロングモントの遺伝子治療薬工場を買収。これによって、プラスミドDNAからウイルスベクター(レンチウイルスベクター/レトロウイルスベクター/アデノ随伴ウイルスベクター)、細胞治療薬まで幅広くカバーする事業体制が完成した。
一方、合成医農薬品の分野では、2017年にスペインの合成医薬品原薬製造工場を買収。さらに2020年には同工場の設備増強を決定、今後の増産を見越した体制を整えている。製造能力の増強と同時に粉砕設備も新設し、原薬製造から粉砕工程の一貫受託製造を実現。そして研究開発施設を新設し、化学実験用ドラフト、合成装置、分析装置などを増設する予定だ。これによって、高薬理開発医薬品や60Lまでの合成反応に適応できる見込みである。
とかく日本企業は、M&Aによって取得した海外企業のリソースを上手に活用するのが苦手だと言われる。特に、異分野の企業を吸収するとなればなおさらだ。ただし、この評価はAGCに関しては当てはまらない。
小室氏は「2018年に海外法人をグローバル統合してAGCバイオロジクス社を立ち上げたタイミングで、外食産業のフランチャイズ制と同様に、組織のあり方や状況報告、会議による意思決定など、海外法人の運営フォーマットを明確に定めました。そして、2019年から同じマネジメント手法で管理しています」と言う。
現在AGCは、日米欧の3極に10拠点を保有することで、より有利な条件で原薬を供給できる体制を整えている。そして、各拠点で生産性を最大限まで高め、高いレベルで同一品質でのcGMP生産が可能な拠点運用と品質保証の体制を確立した。
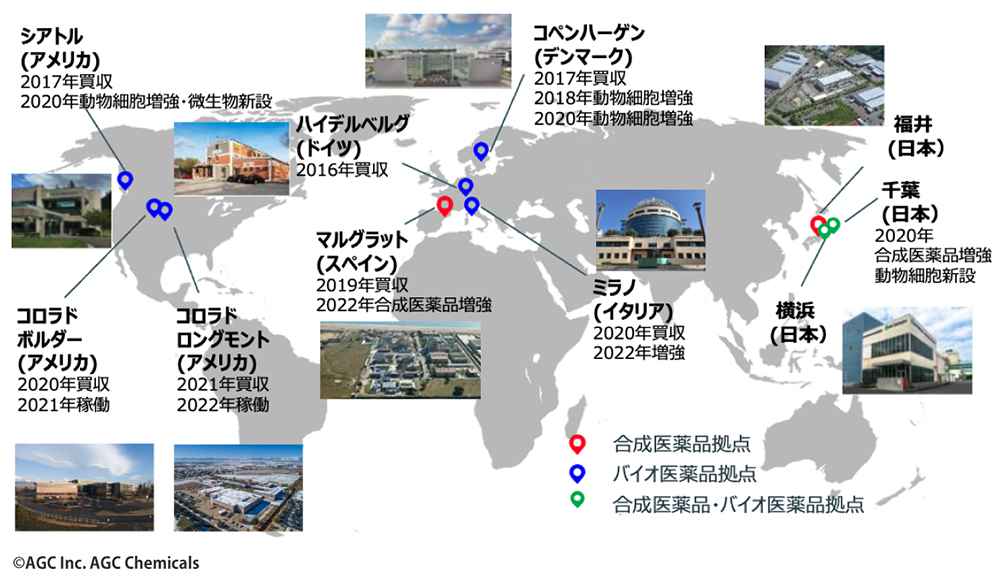
図5 世界各地に置かれたAGCのCDMOビジネスの拠点
世界各地の製造拠点は、買収した企業がそれぞれ利用していた設備が置かれる。製造工程は既設設備にフィットさせる必要があるため、すべての製造工程がグローバルで標準化できるわけではない。ただし、化学品カンパニー ライフサイエンス事業本部 AGCバイオロジクス 日本サイトヘッドの高見潤氏は「高品質と高効率は、委託元の製薬会社がCDMOに最も期待していることだと考えています。このため、品質やオペレーションの効率を高めていく際の視点や手法に関してはトップダウン的に管理する体制を整えています。さらに、これから増強していく設備に関しては統一基準に沿って設置する予定です。各拠点の製造体制のさらなる統一を目指します」と語る。

化学品カンパニー ライフサイエンス事業本部 AGCバイオロジクス 日本サイトヘッド 高見 潤氏

化学品カンパニー ライフサイエンス事業本部 AGCバイオロジクス 日本サイト Quality ヘッド 竹澤 健一氏
厳格な品質保証を可能にするための管理体制の整備も手抜かりない。化学品カンパニー ライフサイエンス事業本部 AGCバイオロジクス 日本サイト Qualityヘッドの竹澤健一氏は「AGCバイオロジクス社の本社がある米国シアトルに品質部門(Quality)の責任者と会社全体のコーポレートQuality組織を置いています。そこで品質のコアとなる考え方を統一し、各拠点間で共有し、擦り合わせたうえで多言語を用い手順書に反映させています。つまり、同一内容の手順書に加え、各拠点固有の事情により細かな手順までは一本化できないものは、統一した考え方との差異が無いことをコーポレートQualityと各拠点間でチェックして、世界共通で使用する管理システムのうえで各拠点の活動状況を可視化して管理しています。また、拠点間で連携し、知見を共有しながら、さらに高レベルでのcGMP管理が可能になるようにしています」と同社のグローバル品質保証体制を説明している。
AGCは、医薬品市場において現時点でCDMOビジネスが成立する領域では、すべての分野への参入が完了したと言える(図6)。ただしCDMOビジネスを営む企業には、常に最先端の製薬技術やニーズへの対応が求められる。
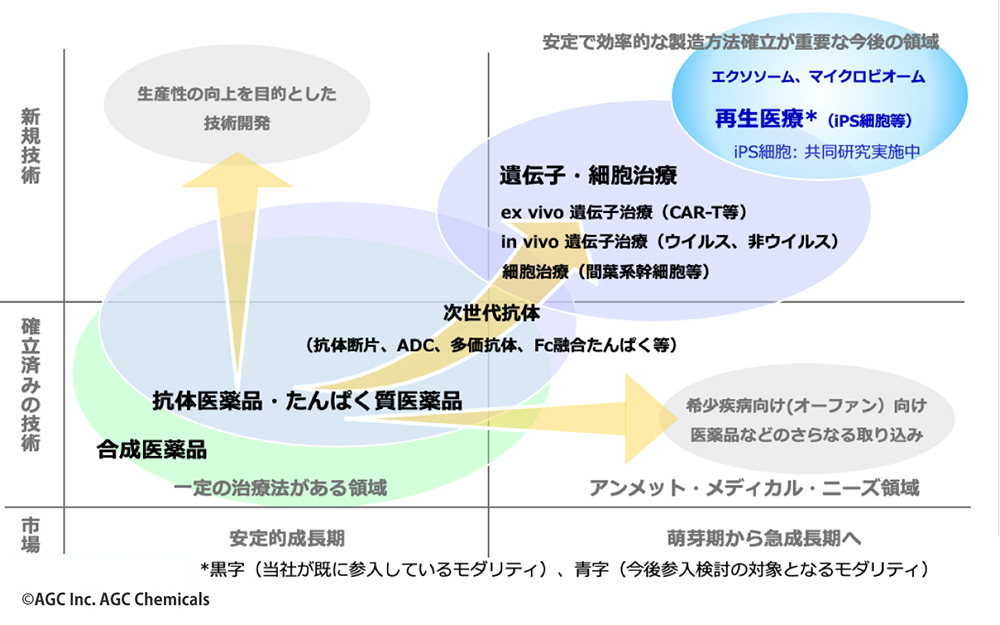
図6 AGCによるCDMOビジネスの展開
「製薬会社が⼿がける新技術への対応は着実に準備しておく必要があると考えています。再生医療のような、個々の患者さんへのカスタマイズが求められる領域でCDMOが貢献できるところは少ないかもしれません。しかし、将来の実用化に向けて研究が進む開発黎明期の新技術はたくさんあります。相応の時期を見極めて参入を検討しています。また、現時点でCDMOが製造しているバイオ医薬品は15%程度で低分子の合成医薬品と比べるとまだ低いです。CDMOでの製造実績が蓄積したことで、製薬会社は、今後バイオ医薬品に関しても製造を積極的に外部委託していく流れにあり、バイオ医薬品のCDMO市場は年率10%を超える見込みです。私たちは、新技術の取り込みと並行し増産対応にも引き続き取り組んでいきます」と小室氏は言う。製薬業界でのAGCの役割は、今後も継続的に広がり続けていく。

日経クロステック Special 掲載記事