AGC Research Report 70(2020)
無アルカリガラス中サブppmレベルの微量ヒ素定量方法
Determination of sub-ppm arsenic in non-alkali glass for LCD substrate
西條佳孝*・鈴木祐一**・秋山良司*
Yoshitaka Saijo, Yuichi Suzuki, and Ryoji Akiyama
*AGC株式会社 先端基盤研究所( yoshitaka.saijo@agc.com)
**AGC株式会社 電子カンパニー(yuichi.suzuki@agc.com)
無アルカリガラス中の微量ヒ素定量について検討し、フッ化水素酸-過塩素酸分解-水素化物発生ICP発光分光法を確立した。ガラスの酸分解処理においては、フッ化水素酸とともに過塩素酸を用いた。過塩素酸は硫酸を用いた際に生成する難溶性のSrSO4やBaSO4の生成を防ぐために使用した。分解容器は水素化物発生法における妨害を防ぐため、Pt皿ではなくPTFE製容器を用いた。また、ガラス分解時にAsが揮散しないようAs(V)にする必要があり、ここでは過マンガン酸カリウムを用いることが有効であった。分解後はMnO2が生成するため過酸化水素にて溶解させた。その後、水素化物発生効率の高いAs(III)にするため予備還元を行った。添加回収試験より正確な定量が可能であることを確認し、空試験値から見積もった定量下限はAsとして0.05μg/gであった。
We propose a method to determine trace arsenic(As)in non-alkali glass for liquid-crystal display substrates. The As concentration is determined by hydride generation combined with inductively coupled plasma atomic-emission spectroscopy after hydrofluoric acid and perchloric acid decomposition. Perchloric acid prevents the generation of hardly soluble salts, such as SrSO4 and BaSO4, which are generated when using sulfuric acid. Adequate control of the As valence during pretreatment with the oxidizing and reducing agents is necessary for accurate determination of As. Potassium permanganate is added to hydrofluoric acid and perchloric acid decomposition liquid to oxidize As(III)to As(V)and prevent As evaporation during glass decomposition. MnO2, which is generated from potassium permanganate, is dissolved with hydrogen peroxide. Prereduction to As(III)is necessary before the hydride-generation step. Evaporation dishes made of polytetrafluoroethylene instead of Pt were used for the decomposition to avoid interfering with the hydridegeneration reaction between As and nascent hydrogen. The recovery of As by using the recovery test was 100%– 110% for 0.2–15 μg/g As. The As determination limit calculated from the blank tests is 0.05μg/g.
1. 緒言
無アルカリガラスは、Li2O, Na2O, K2Oなどのアルカリ金属酸化物をほとんど含まず、SiO2, B2O3, Al2O3及びアルカリ土類金属酸化物を主成分とするホウ珪酸ガラスである。AGC株式会社では液晶TVなどのFlatPanel Display(FPD)の無アルカリガラス基板として、1992年よりAN635、1999年よりAN100を製造、販売してきた。それらの基板は開発当初より清澄過程でヒ素やアンチモンなどの有害物質を使用しておらず、環境汚染の非常に少ないガラスとして市場から高い評価を得ている[1]。一方で本市場においては当初主にヒ素酸化物を用いた清澄が行われてきた[2]が、近年ヒ素酸化物については各国の規制が強化されている。例えばヒ素酸化物は三酸化二ヒ素(As2O3)、五酸化二ヒ素(As2O5)ともREACH(registration,evaluation, authorization, and restriction of chemicals)におけるECHA(European Chemical Agency)のSVHCs(substances of very high concern)に挙げられている[3][4]。そのような背景から、現在のところ全ての無アルカリガラスはヒ素等の有害金属を実質的に含まないとされている。
ここでいう「実質的に含まない」とは、ガラスの公定分析法[5][6]において定量下限以下であることを意味すると考えられる。しかし、例えばJIS法[5]におけるホウ珪酸ガラス中のヒ素量の検出下限は、 As2O3、として20μg/g(Asとして約15μg/g)である。したがって、それ以下、例えば1μg/g以下の極めて微量のレベルにおけるヒ素量についてはこれまで分析方法が確立されていない。現在、TV受像機はCathodeRay Tube(CRT)からFPDへの交代がほぼなされ、FPDの廃棄もしくはリサイクルが進んでいく現状[7][8]において、企業の社会的責任として製品中のヒ素などの有害金属量を把握し管理することは重要と考えられる。
以上の背景から、ここではより高感度な無アルカリガラス中の微量ヒ素定量法を検討した。JIS法[5]においては試料を酸などで溶解した後に液性を整え、モリブデン青吸光光度法にてヒ素を定量する。ここで、一般的に感度を向上させ微量分析を検討する際は、検出方法の高感度化が最も近道であると考えられる。そこで、アルゴンガスによって生成される高温の誘導結合プラズマ中に試料を導き、試料中の元素を原子化・熱励起し、基底状態に戻る際の発光スペクトルを分光し読み取るICP発光分光法や、同様の手法により試料中の元素をイオン化し、質量分析計にて分析を行う、より高感度なICP-MS法の活用が考えられる。しかし、一般的なICP発光分光法では、ガラス中の1μg/g以下の極めて微量のレベルにおけるヒ素量の分析は困難である。次に、一般的な四重極型質量分析計を用いるICP-MS法での75Asの分析においては、40Ar35Clや40Ca35Clによる質量干渉、150Nd2+や、150Sm2+などの希土類元素の二価イオンによる質量干渉が問題になることが一般的に知られている。これらのそれぞれ多原子イオンへの対策にはコリジョン・リアクション技術を用いる多原子イオンの低減法[9]、二価イオンの干渉除去にはH2リアクション法[10]が有効である。さらに質量干渉を抑制するためには、磁場と電場により質量分離する二重収束型ICP-MSを用いる、もしくは近年発表された二つの質量分析部とその中間に反応セルを持つICP-MS/MS[11]を用い、O2によりマスシフトさせ酸素付加体(75As16O+)を測定する方法[12]がある。しかしいずれの装置も高価であり、一般的なガラス分析環境にて実施することは難しいのが実情である。また、高感度な装置に、前処理にて分離可能なSi、B以外のすべてのガラス組成に含まれる元素が残留する高マトリックス溶液であるガラス分解液を導入することで、主成分元素による汚染や、装置の故障が懸念される。
一方、ヒ素の高感度分析方法の一つとして、工業廃水試験方法[13]などに採用されている水素化物発生法がある。本法は化学反応によって化合物から遊離した直後の発生期の水素により水素化物を形成する元素(主にAs, Sb, Seなど)に使用される手法である。本法の歴史は古く、1960年代に原子吸光法と組み合わされ微量ヒ素の定量法として開発された[14]のち、還元剤の改良[15]やICP発光分光法との組み合わせが開発された。現在、Asについては、主に塩酸と水素化ホウ素ナトリウムが反応する際に生成する発生期の水素により、AsをAsH3に還元し気体として水溶液マトリックスから分離後、原子吸光法装置のフレームや、ICP発光分光装置のプラズマに導入する手法が用いられている。
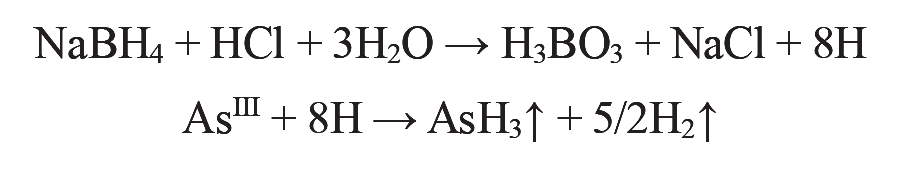
水素化物発生法では試料導入効率が大幅に向上するため、通常の水溶液導入に対し30倍以上高感度化される。よってICP-MSのような高感度な装置を用いずとも、微量分析が達成できる。
一方で、ガラス中のヒ素の水素化物発生法による定量検討はほとんどなされていない。ガラス中のヒ素を測定する際は前述のようにガラスの酸分解を必須とすることから、一般の工業廃水試験方法をそのまま適用することは困難である。例えばAsH3発生効率は溶液中As価数により異なり、As(III)> As(V)である[16][17]ため、水素化物発生装置への導入時には、AsをIII価の状態にしておく[18][19]ことが必要である。一方でAs(III)は酸分解過程において揮散する可能性がある[5]ため、ガラス試料の場合は、その酸分解過程においてはヒ素をAs(V)状態にしておく必要がある。このように、ガラス分解処理においてAsの価数をコントロールすることが極めて重要となる。また、水素化物発生法の妨害種としてHNO3, Cu, Ni, Feなどの遷移金属、Pt, Au, Agなどの貴金属があることが知られている[5]。測定時これらの妨害種を含む場合は、十分な検討確認を行う必要がある。ここで、ガラスに極めて近い材料への適用として、ヒ素水素化物発生法による地質(ケイ酸塩)中のヒ素量分析が研究されている[20]。その際、SiO2を主成分とするケイ酸塩はフッ化水素酸及び硫酸にて加熱分解する。一方で、本研究の対象となる無アルカリガラス基板は同様に酸分解を行うと、地質にはほとんど含まれないSrO,BaOが硫酸と反応し難溶性の化合物を生成することが問題となる。ここで、硫酸は揮発せずに残るガラス組成成分と可溶性の塩を生成させるために加えられる高沸点の酸として用いられている。一般のガラスの公定分析法においても該高沸点の酸として硫酸が用いられるが、ここではSrO, BaOなどと難溶性の化合物を生じない高沸点の酸として、過塩素酸が適していると考えられる。
以上より、本報告においては一般的なガラス分析環境にて実施可能である、フッ化水素酸過塩素酸分解水素化物発生ICP発光分光法による無アルカリガラス中の微量ヒ素定量法を確立することを目的とする。
2. 実験方法
2.1. 試料
当社製無アルカリガラスAN100と、市場より回収した当社製以外の無アルカリガラス3点(B, C, Dと呼称する)を試料とした。
2.2. 装置
日立ハイテク社製ICP発光分光装置 SPS5520および日立ハイテク社製水素化物発生装置 HTG-1200を用いた。
2.3. 試薬
以下の試薬を用い、分析に必要な溶液を調整した。
- 関東化学社製原子吸光分析用塩酸
- 関東化学社製原子吸光分析用フッ化水素酸
- 関東化学社製原子吸光分析用過塩素酸
- 関東化学社製特級過酸化水素
- 関東化学社製特級水酸化ナトリウム
- 関東化学社製原子吸光分析用水素化ホウ素ナトリウム
- 関東化学社製鹿特級ヨウ化ナトリウム
- 純正化学社製特級過マンガン酸カリウム
- 関東化学社製As標準溶液 100mg/L
各溶液の調整方法を以下に示す。
- 10g/L NaBH4 :NaOH約2gをイオン交換水に溶解した後、NaBH4 5gを加え、イオン交換水で500mLに定容する
- 6 mol/L HCl :36 wt% HCl 250mLをイオン交換水で500mLに定容する
- 1 mol/L HCl :36 wt% HCl 41mLをイオン交換水で500mLに定容する
- 10g/L KMnO4:KMnO4 0.5gをイオン交換水で50mLに定容する
- 3 wt% H2O2:30 wt% H2O2 1mLをイオン交換水で10mLに定容する
- 200g/L NaI:NaI 20gをイオン交換水で100mLに定容する
2.4. 分析操作
2.4.1. ガラス試料の溶解
試料であるガラスを用意し、アルミナ乳鉢を用いて粗粉砕した。その後メノウ乳鉢を用いて250μmφ以下となるまで粉砕して粉末状のガラス試料を得た。このガラス試料0.5g、10g/L過マンガン酸カリウム0.3mL、過塩素酸5mL、フッ化水素酸10mLをPTFE製容器に入れ、約200℃に加熱した。白煙の発生後、残留する過塩素酸量が約2mLになるまで加熱を続けた。
2.4.2. 二酸化マンガンの溶解
2.4.1.にて得られたガラス分解溶液を室温まで冷却した後に6mol/L塩酸10mLを加え塩酸溶液とした。ついで3wt% 過酸化水素水30μL(約0.03g)を加えた。
2.4.3. 予備還元
2.4.2.にて得られた溶液に200g/L ヨウ化ナトリウム 10mLを加え、80~90℃の水浴で30分間加熱し、測定用ガラス溶液を得た。
2.4.4. 水素化物発生法によるヒ素量の定量
水素化物導入の概念図をFig. 1に示す。水素化物発生装置を用い、発生期の水素を発生させる第1段階において測定用ガラス溶液と1mol/L塩酸を混合した。つぎに第2段階において水素化ホウ素ナトリウム10g/Lを混合して発生期の水素を生成させ、測定用ガラス溶液中のヒ素を還元しAsH3を発生させ、ヒ素量をICP発光分光装置にて測定した。水素化物発生装置のポンプ回転量、導入Ar量はバックグラウンドとなる超純水を導入した際の強度、及びAs標準試料の強度により調整を行った。典型的な導入Ar量は0.6L/min.とした。またICP発光分光装置の条件をTable 1に示す。
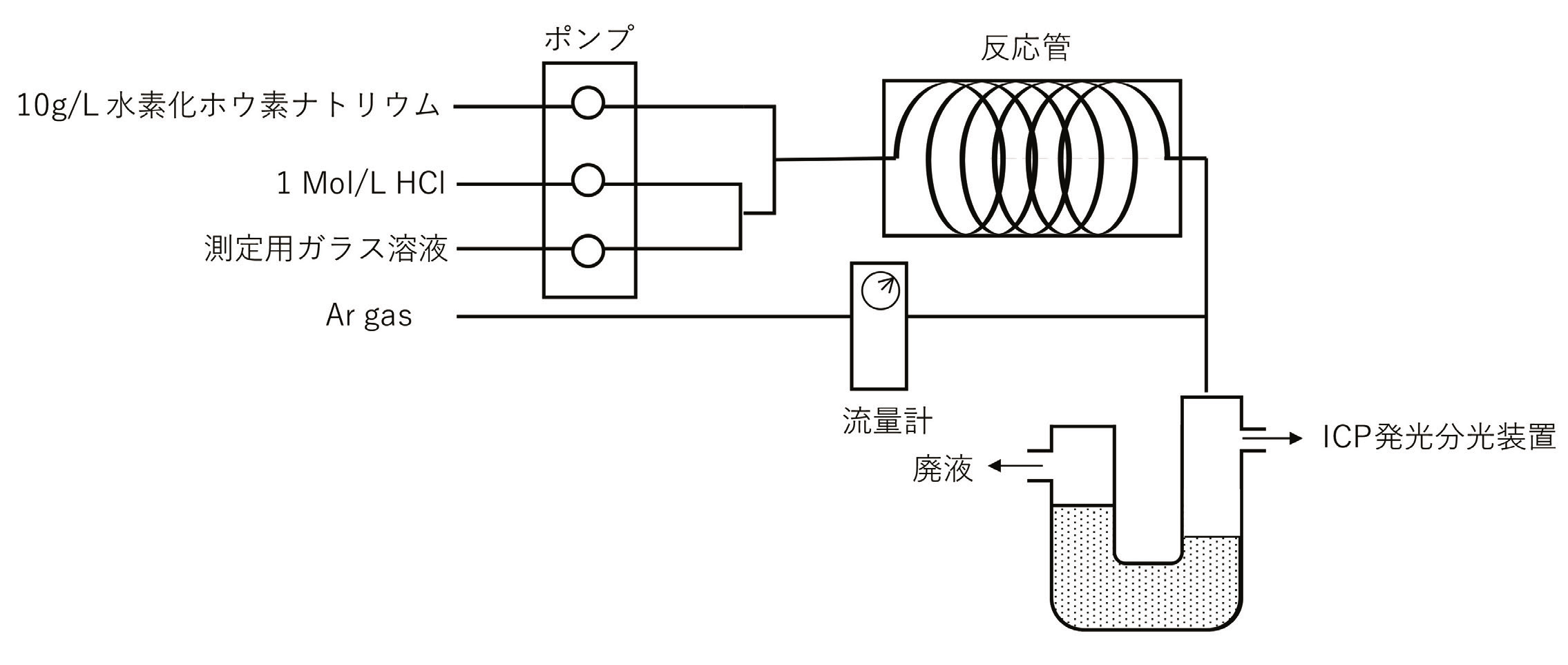 Fig. 1 Schematic diagram of hydride introducing method.
Fig. 1 Schematic diagram of hydride introducing method.
2.4.5. 添加回収実験
上記ガラス試料1gに対してヒ素量が1μgとなるようにヒ素の標準液を加えた検証用ガラス試料を作製し、同様にヒ素含有量値を定量した。(該定量値から前記ヒ素含有量値を除いた値)/(添加したヒ素量)=添加回収率、と定義し添加回収率を求めた。
2.4.6. 分析方法の妥当性の検証
各プロセスについて、条件を変えた試験を行い、添加回収率を確認することで実験方法の妥当性の検証を行った。試料はガラスDを用いた。
2.4.7. 定量下限値の検証
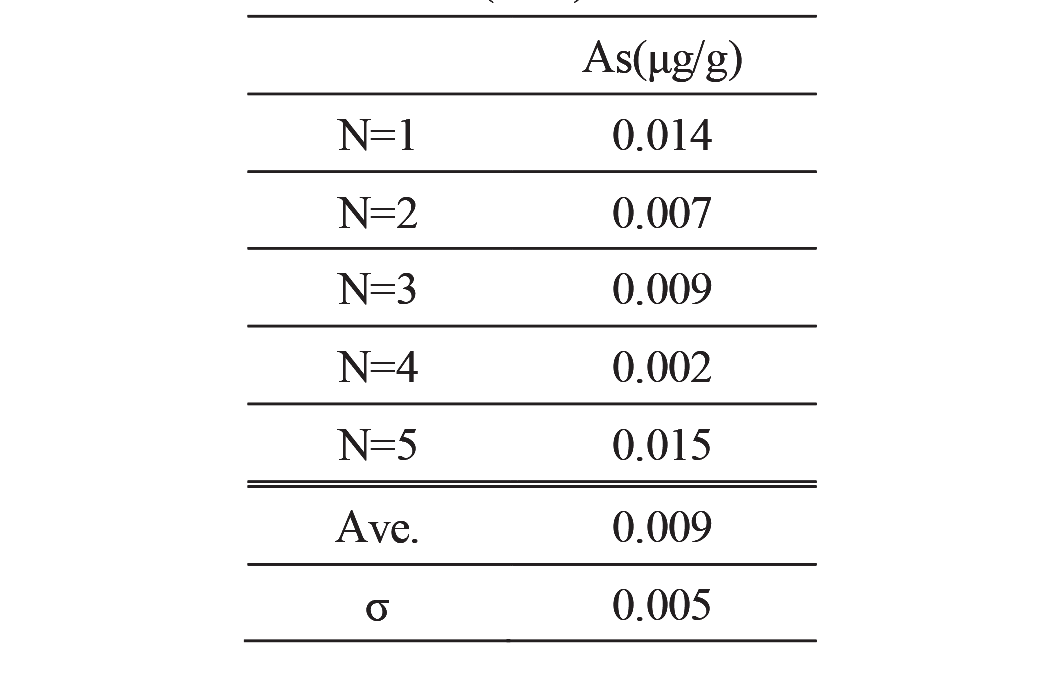
空試験をN=5で行い、試料を0.5g使用した際のブランク値を算出し、その標準偏差の10倍(10σ)を定量下限値として算出した。
3. 実験結果及び考察
3.1. 試料中のヒ素量及び添加回収率
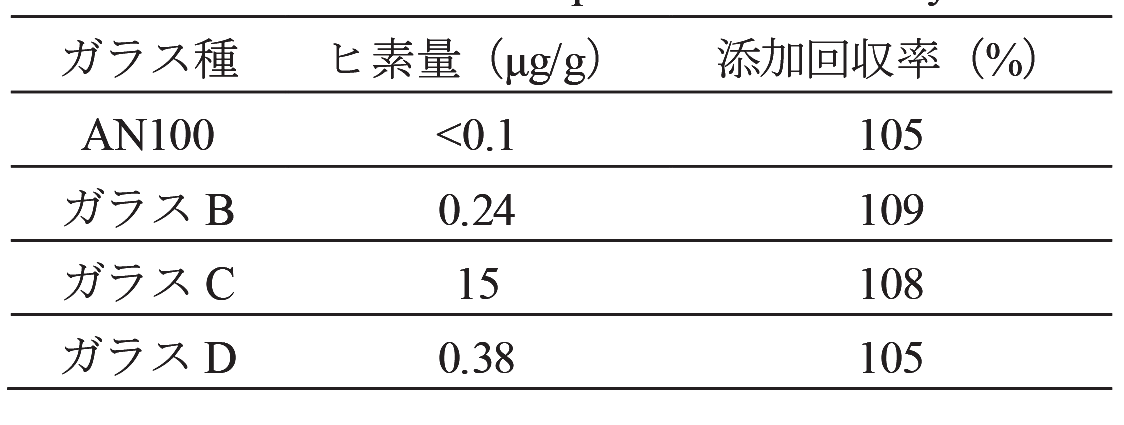
2.4.1.~2.4.5.に従って得られた試料中のヒ素量及び添加回収率をTable 2に示す。本分析フローを用いることで、100~109%の添加回収率を得られることが分かった。添加回収実験は、実験の妥当性を確認する手法であり、Codex委員会の化学物質の定量分析法が満たすべき性能規準とガイドライン[21]を参考にすると、0.1μg/g~1μg/g範囲における妥当な添加回収率範囲は80~110%であり、それを満たすことが分かる。よって今回開発した分析方法により、液晶TVなどに用いられる無アルカリガラス基板中の微量のヒ素量を正確に定量することが可能であることが確かめられた。その結果として、当社製AN100からはヒ素は検出されず、0.1μg/g以下であることが分かった。一方でその他のTV用無アルカリガラスからは0.2μg/g以上のヒ素が含有されることが分かった。これは、原料からの混入などの原因が考えられる。
3.2. ガラス試料の溶解の検討
3.2.1. 分解容器の検討
2.4.1.ガラス試料の溶解において、PTFE製容器の代わりにPt製容器を用い、それ以外は同様に実験を行いガラスD中のヒ素含有量及び添加回収率を測定した結果をTable 3に示す。ヒ素量は0.1μg/g以下、また添加回収率は0%であり、適正に定量できていないことが分かる。
通常ガラスの酸分解を行う際はPt容器が用いられるが、本結果より本法においては、Pt容器を用いるとヒ素の定量値が低値を示すことが分かる。その理由としてPt容器を用いることでガラス分解溶液にPtが微量に溶解し、水素化物発生段階において水素化物発生を妨害したためと考えられる。ここでヒ素量を一定とした標準液にPtを添加しその相対強度の変化を確認した結果をFig. 2に示す。ヒ素の相対強度はPt 0.5μg/mLの添加で約10%、10μm/mLの添加で約45%の低下をそれぞれ示すことが分かる。本試験において添加回収率が0%であったことを考慮すると、Pt皿を用いたガラス分解の際には、10μg/mL以上のPtが分解液に溶出したと推察される。
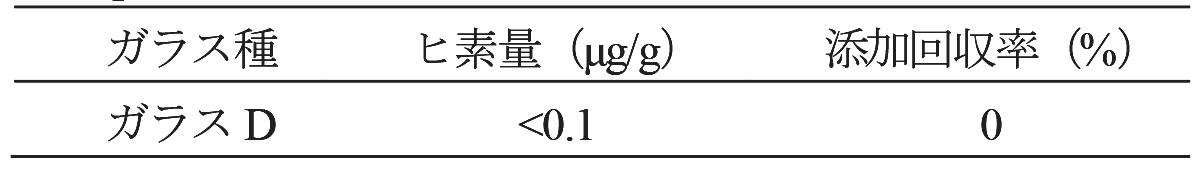
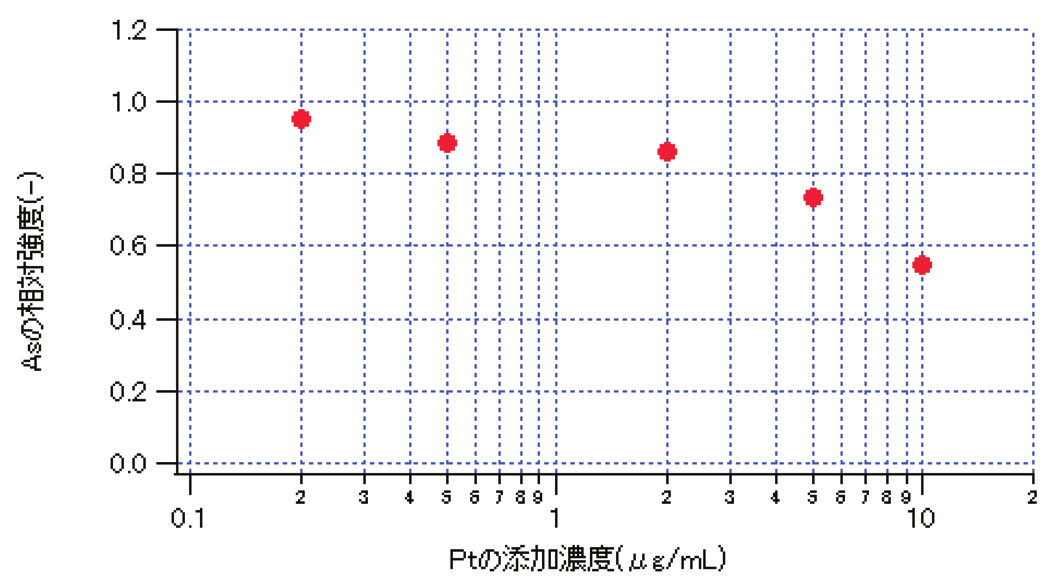 Fig. 2 Effect of Platinum concentration on the Arsenic intensity.
Fig. 2 Effect of Platinum concentration on the Arsenic intensity.3.2.2. 酸化剤及び濃縮の程度の検討
2.4.1.ガラス試料の溶解において、過マンガン酸カリウムを用いず、それ以外は同様に実験を行いガラスD中のヒ素含有量及び添加回収率を測定した結果をTable 4に示す。ヒ素量は0.26μg/g、添加回収率は65%であり、適正に定量できていないことが分かる。すなわち、本分析には適正な酸化剤の添加が必要である。これは、酸化剤を添加しない場合、揮散しやすいAs(III)が系外に揮散したためと考えられる。したがって、ガラス分解時には酸化剤を用い揮散しづらいAs(V)の形態にすることが必要である。

同様にガラス試料の溶解において、高沸点の酸としての過塩素酸がなくなり残留する塩が乾固するまで加熱し、それ以外は同様に実験を行いガラスD中のヒ素含有量及び添加回収率を測定した結果をTable 5に示す。ヒ素量は0.25μg/g、添加回収率は60%であり、適正な定量ができていないことが分かる。これは、酸化剤を添加した場合においても、ガラス溶解液を乾固するとヒ素が系外に揮散することを示すと考えられ、適切な濃縮の程度を保つことが重要である。

3.3. 二酸化マンガンの溶解の検討
2.4.2.二酸化マンガンの溶解において、過酸化水素を加えず、それ以外は同様に実験を行いガラスD中のヒ素含有量を測定した結果をTable 6に示す。ヒ素量は0.30μg/gであり、3.1の結果に対して低値である。ガラス分解時にヒ素に対する酸化剤として添加したMn(VII)は、酸化還元反応によりMn2+を生成するが、一部褐色のMnO2(正確には水和物Mn O2・nH2O)が生成する。過酸化水素は酸性条件下でMn(VII)及びMn(IV)に対し還元剤として働き、Mn(VII)及びMn(IV)はMn2+に還元される[22]。なお、過酸化水素を加えると、MnO2は速やかに溶解した。MnO2を溶解しない場合、ヒ素の一部がMnO2に取り込まれ[23]、ヒ素量が低値を示したと推察される。なお、本実験において添加回収実験は実施していない。

3.4. 予備還元の検討
2.4.3.予備還元を行わずに、それ以外は同様に実験を行いガラスD中のヒ素含有量及び添加回収率を測定した結果をTable 7に示す。ヒ素量は0.12μg/g、添加回収率は30%であり、適正な定量ができていないことが分かる。予備還元を行わない際に定量値が低値を示すのは分解液中に存在するAs(V)が水素化物を形成しにくく[16][17]、検出されなかったためと推察される。したがって、水素化物発生法を用いてヒ素を定量する段階においては予備還元を行い、ヒ素をAs(III)の形態にする[18]ことが必要である。

3.5. 定量下限値の確認
N=5で行った空試験値の結果及びその標準偏差をTable 8に示す。空試験値の10σを定量下限値と定義すると、ヒ素量の定量下限値は0.05μg/gである。
4. 総括
無アルカリガラスは、Li2O, Na2O, K2Oなどのアルカリ金属酸化物をほとんど含まず、SiO2, B2O3, Al2O3及びアルカリ土類金属酸化物を主成分とするホウ珪酸ガラスであり、TFT液晶などの無アルカリガラス基板として用いられる。現在、CRTからFPDへの交代がほぼなされ、FPDの廃棄もしくはリサイクルが進んでいく中において、企業の社会的責任として製品中のヒ素などの有害金属量を把握し管理することは重要と考え、ガラス中の微量ヒ素の定量方法を検討した。無アルカリガラス中の微量ヒ素定量について、フッ化水素酸-過塩素酸分解-水素化物発生ICP発光分光法を検討し、添加回収試験より正確な定量が可能な前処理及び定量フローを確立した。ガラスの酸分解処理においては、フッ化水素酸とともに、難溶性塩の生成を防ぐため過塩素酸を用いた。分解容器は水素化物発生法の妨害を防ぐため、Pt皿ではなくPTFE製容器を用いた。また、ガラス分解時にAsが揮散しないようAs(V) にする必要があり、ここでは過マンガン酸カリウムを用いることが有効であった。分解後はMnO2が生成するため、過酸化水素にて溶解させた後、水素化物発生効率の高いAs(III) にするため予備還元を行った。このように、Asを所望の価数になるよう酸化剤、還元剤を調整することが重要である。空試験値から見積もった定量下限はAsとして0.05μg/gであった。
参考文献
- 石川博幸, "FPD用ガラス基板の現状と将来," Res. ReportsAsahi Glass Co., Ltd.,, 57, 2007
- Adam Ellison and Iva´n A. Cornejo, Int. J. Appl. Glass.Sci ., 1[ 1]87(2010)
- ECHA, [オンライン]. Available: https://echa.europa.eu/substance-information/-/substanceinfo/100.013.743. [アクセス日: 28 1 2020]
- ECHA. [オンライン]. Available: https://echa.europa.eu/substance-information/-/substanceinfo/100.014.075. [アクセス日: 28 1 2020]
- JIS R 3105
- ASTM C 169-16
- 産業技術連携推進会議, "液晶パネルガラスのリサイクル技術の開発," ガラスリサイクル開発事例集, 2, 2019
- 株式会社イースクエア ガラス再資源化協議会, "廃液晶ガラス・廃自動車ガラス等の高度再資源化システムの研究開発,"平成26年度環境研究総合推進費補助金 次世代事業 総合技術開発報告書,(2015)
- 高橋純一, 分化, 53, 1257,(2004)
- B. P. Jacson, A. Liba, J. Nelson, J. Anal. At. Spectrom , 30,1179,(2015)
- K. K. Murray, R. K. Boyd, M. N. Eberlin, G. J. Langley, L.Li, Y. Naito, Pure Appl. Chem., 85, 1515,(2013)
- C. D. B. Amarillo, R. S. Amaris, L. L. Fialho, D. Schiave, T.Amorim, A. R. A. Nogueira, F. R. P. Rocha, J. A. Nobrega.Amarillo, Anal. Methods , 7, 1215,(2015)
- JIS K 0102
- W. Holak, Anal. Chem., 41, 1712,(1969)
- Royer, Frank J. Schmidt and James L. Anal. Lett ., 6, 17,(1973)
- M. O. Andreae, Anal. Chem., 49, 820,(1977)
- 中原 武利, 分化, 41, 65,(1992)
- 熊丸 尚宏, 分化, 32, 357,(1983)
- 中村 靖, 分化, 22, 1543,(1973)
- 寺島 滋, 分化, 23, 1331,(1974)
- Criteria Approaches for Methods which Use a ‘Sum ofComponents’, [オンライン]Available: http://www.fao.org/fao-who-codexalimentarius/resources/inf-doc/en/ [アクセス日: 17 6 2020]
- 前川 静弥 分化, 16, 354,(1967)
- 倉田 奈津子 分化, 40, 33,(1991)