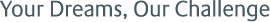AGC Research Report 71(2021)
フッ素を用いた水和構造制御と生体親和性の発現
Control of hydration structure with fluorine and expression of biocompatibility
小口亮平*
Ryohei Koguchi
*AGC株式会社 材料融合研究所(ryohei.koguchi@agc.com)
生体親和性を示す材料として、ポリ(2-メトキシエチルアクリレート)(PMEA)があり、タンパク質が吸着せず細胞を活性化させない。含水状態のPMEAには、中程度にポリマーと相互作用する中間水の存在が先行研究から明らかになっており、生体親和性と高い相関が認められている。本報告では、新規な水和構造制御方法を提案し、優れた生体親和性材料を開発することを目的に、ポリ(2-ヒドロキシエチルメタクリレート)(PHEMA)とPMEA共重合体を設計し、水和構造の考察および生体親和性の評価を行った。
HEMAに親水性の2-(ジメチルアミノ)エチルメタクリレートを共重合すると、HEMA-水間の強固な水素結合ネットワーク構造を緩ませ水和水全体の運動性も高まり、逆に疎水性の2,2,2-トリフルオロエチルメタクリレート(TFEMA)を共重合すると水和水全体の運動性も低下した。これらの水和構造の変化が選択的な中間水の増加ならびに生体親和性の向上に繋がったと考察される。
次に、TFEMAを低分子量で重合したマクロモノマーを開始剤としてMEAと重合しSolid F-PMEAを得た。Solid F-PMEA膜の界面では含水すると徐々に凹凸構造を形成した。弾性率測定結果から凹部がPTFEMAに、凸部がPMEAにそれぞれ変化していると考えられる。Solid F-PMEAは十分に中間水があるにも関わらず、血小板粘着を防ぐ効果は低かった。その理由としては疎水性を示すPTFEMAの凹部が血小板の足場になったためと考察される。
これらの結果より、少量の異種モノマーにより水和構造制御が可能であることを見いだすとともに、優れた生体親和性界面を構築するためには、十分な中間水を含む鎖が効率的に水界面に配向する必要があると結論した。
As a biocompatible material, there is poly (2-methoxyethyl acrylate) (PMEA), which does not adsorb proteins and does not activate cells. Previous studies have revealed that PMEA in the hydration structure has intermediate water that interacts with the polymer to a moderately and a high correlation with biocompatibility has been observed. In this report, we designed a poly (2-hydroxyethyl methacrylate)(PHEMA) and PMEA copolymers for the purpose of proposing a novel hydration structure control method and developing excellent biocompatible materials.
Copolymerizing hydrophilic 2-(dimethylamino)ethyl methacrylate with HEMA loosened the strong hydrogen bond network and enhanced the motility of the hydrated water, and copolymerizing hydrophobic 2,2,2-trifluoroethyl methacrylate (TFEMA) conversely reduced the motility of the hydrated water. It was interpreted that these changes in the hydration structure led to the selective increase in intermediate water and the improvement of biocompatibility.
Next, a macromonomer obtained by polymerizing TFEMA with a low molecular weight was polymerized with MEA as an initiator to obtain solid F-PMEA. The solid F-PMEA film gradually formed, an uneven structure, when its interface contained water. The elastic modulus measurement results indicated that the concave part has changed to PTFEMA and the convex part has changed to PMEA. It was considered that the reason why solid F-PMEA had a low effect on inhibiting platelet adhesion even though there was sufficient intermediate water was that the concave portion composed by hydrophobic PTFEMA became a scaffold for platelets.
From these results, it was found that the hydration structure can be controlled with a small amount of different monomers, and we concluded that the chains containing sufficient intermediate water were efficiently oriented at the water interface, in order to have an excellent biocompatibility interface.
1. 緒言
世界的に高齢化が進み、健康で生活するための技術革新が重要な政策として挙げられており、医療が担う役割は大きい。我が国の医療機器市場規模は2004年以降増加に転じ、2兆円を超える規模で推移し、2017年には3兆円を突破している(1)。その中でもカテーテル、人工関節、心臓ペースメーカーに代表される治療機器に関しては輸入品の占める割合が高い。2017年時点で、医療機器全体としては約1兆円の貿易赤字になっており、輸入超過の貿易不均衡が生じている。今後も断続的な高齢化に伴う医療費の増加が予想されている。
こうした背景から病気の予防、診断、治療技術を支える医療機器に求められる期待は大きくなっており、医療現場では安価で安全性の高い医療用の材料開発が強く求められている。また医療機器を構成する医療用材料の材質としては、金属、セラミックス、ポリマーに大別される。この内、ポリマーは設計・加工の自由度が高く、分子設計による特性の制御や機能の付加が容易である。人工材料が生体内で使用される際、普遍的に求められる特性の1つとして、異物として認識されない特性があげられる。この特性を本報告では、生体親和性と定義し、特にポリマー材料に焦点を当てた。
2. 材料設計指針
2.1. 先行研究例
これまでに数多くの生体親和性ポリマーに関して研究が行われてきた。代表的なポリマーをFig. 1に記載する。
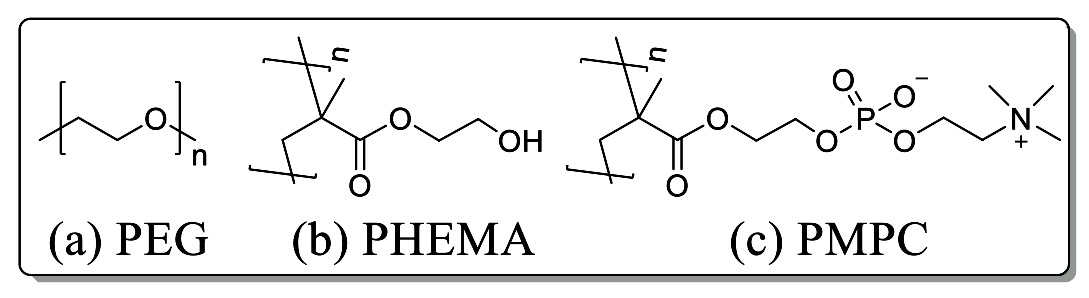 Fig. 1 Typical biocompatible polymers.
Fig. 1 Typical biocompatible polymers.Polyethylene glycol (PEG)は、生体の活動温度域で水に可溶な水溶性ポリマーである。一般的にPEGのような非イオン性の水溶性ポリマーで基材表面を修飾すると、表面の親水性は向上し表面電荷もゼロに近づくため、静電的相互作用に起因するタンパク質分子の接近や吸着を防ぐ効果がある。PEGは単結合による連結鎖のため回転運動が容易であり、水中で柔軟な構造を有する。このことからPEG鎖の排除体積効果がタンパク質吸着を防いでいると説明されている(2)。Poly(2-hydroxyethyl methacrylate)(PHEMA)は側鎖に水酸基を有するために、38 wt% ~40 wt%と高い含水量を示しソフトコンタクトレンズに応用されてきた。ソフトコンタクトレンズはゲル中の水を介して角膜に酸素が供給される。MartinsらはポリウレタンフィルムにHEMAをグラフトさせることで、表面が親水化されるとともに、ヒト血清アルブミンの吸着が抑制されると報告している(3)。1978年にNakabayashiらによって、設計された2 -Methacryloyloxyethyl phosphoryl choline(MPC)は側鎖に細胞膜同様のリン脂質極性基を有するメタクリル酸エステルである(4)。1990年にIshiharaらによって大量合成方法が確立され、医療分野で抗血栓性に代表される生体親和性を有する材料として、広範囲な人工心臓(EVA-HEART)、人工関節(Aquala)、人工心肺(キャピオックスRX)などの医療デバイスに展開されている(5)。
Whitesidesらは生体親和性に必要な条件を系統的に評価するために、疎水性ユニット、エチレングリコールユニット、アミン/アンモニウム塩、アミド、アミノ酸、クラウンエーテル、糖鎖などを導入した自己組織化単分子膜(SAM)膜を作製した(6),(7)。各SAM膜上へのタンパク質であるフィブリノーゲンおよびリゾチームの吸着量を表面プラズモン共鳴から定量化し、タンパク質吸着を抑制する表面のメカニズムについて報告している。各SAM膜上の前進接触角(表面自由エネルギー)や、疎水性の指標となるオクタノール/水分配比率(ClogP)を測定し、タンパク質吸着を抑制するために必要な構成要素として、(1)親水性表面であること、(2)水素結合供与体でないこと、(3)水素結合受容体であること、(4)電気的に中性であることの4点を提案している。
2.2. 水和構造と中間水
生体環境は含水状態であるため、乾燥状態でのパラメーターだけではタンパク質や細胞と材料との相互作用に関して十分な考察ができない。材料界面は多彩な生体反応が進行する場であり、特に界面の水分子は重要な構成要素の1つである。Tanakaらは生体分子にとって異物認識されにくい生体親和性を示す材料としてFig. 2に示すPoly(2-methoxyethyl acrylate)(PMEA)を報告し、材料と相互作用する水に着目した(8),(9)。含水状態のPMEAの示差走査熱量測定(DSC)と含水量測定を行い検出される水を以下の3種類に分類した。-100 ℃でも凍らない水を不凍水(NFW)、-40 ℃付近で低温結晶形成する水を中間水(IW)、および0 ℃で凍結する水を自由水(FW)と定義している。
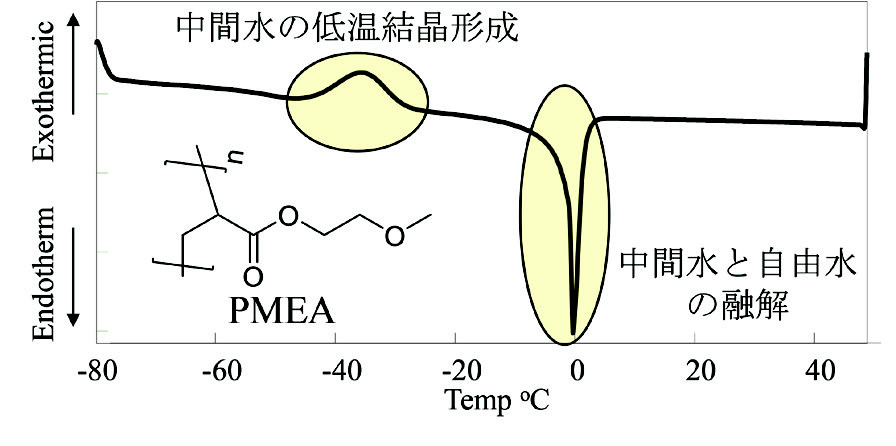 Fig. 2 Heating curve of PMEA-water system.
Fig. 2 Heating curve of PMEA-water system.先行研究より、水-PMEA界面には中程度にポリマーと相互作用する中間水の存在が明らかになっており、生体親和性との高い相関が認められている。近年様々にポリマーの化学構造を変えたPMEA誘導体を合成することで、中間水量を制御する試みがなされており、中間水量が多い材料ほど生体親和性が高いと報告されている。この現象は、材料表面に形成される中間水がポリマーと強く相互作用している不凍水をシールドすることで、タンパク質吸着や細胞の活性化を抑制していると考察されている。
3. 分子設計戦略
KikuchiらはHEMAとN-methyl-N-(4-vinylphenethyl)ethylenediamine (MVEDA) とのコポリマーを用いて、血球細胞の接着挙動の検討を行った。リンパ球の接着はMVEDAが2 mol%であるコポリマーで、極小化することを報告している(10)。この現象は後にTsurutaによって少量のアミノ基が、強固な水素結合ネットワークを緩和させた効果であると考察されている(11)。ZhaoらはHEMAと 2-perfluorooctylethyl methacrylate (FMA) のコポリマーを用いて、アルブミンとフィブリノーゲンの吸着量が、それぞれFMAが7.56 mol%および2.45 mol%の際に極小化することをX線光電分光法(XPS)による表面元素分析結果と共に報告をしている(12)。これらの結果は、少量の異種モノマーを共重合することがマトリックス全体の水和構造に影響を及ぼし、生体親和性を変化させていると推察されるが、系統的には検討されていない。
そこで共重合モノマー構造および組成を変えることで水和構造を制御し、優れた生体親和性材料の開発を目的に分子を設計した。共重合するモノマーとしてはWhitesideらが生体親和性として示していない構成要素を選択することで、化学構造ではなく水和構造と生体親和性の関係性を調査した。具体的には親水性ではあるが電気的に中性でない2-(dimethylamino)ethyl methacrylate (DMAEMA)と、電荷的に中性ではあるが親水性でない2,2,2-trifluoroethyl methacrylate (TFEMA)を共重合モノマーとして選定した。なおマトリックスポリマーとしては含水量が多く水和構造の変化が確認しやすいPHEMAを選択し分子設計指針とした。
3.1. HEMA共重合体(13)
3.1.1. 合成
合成は一般的なラジカル重合で実施した。得られたコポリマーはNX、FYと表記しXおよびYは1H-NMRから算出したそれぞれコポリマー中DMAEMAおよびTFEMAのmol%を意味する。Fig. 3にN-seriesおよびF-seriesの化学構造を示した。
 Fig. 3 Chemical structures of HEMA copolymers.
Fig. 3 Chemical structures of HEMA copolymers.代表的な合成手法を記載する。圧力ガラス容器に1.76 g (13.5 mmol)のHEMA、0.24 g (1.5 mmol)のDMAEMA、9.9 mLのN,N-dimethylformamideおよび20.0 mgの2,2′-azobis(isobutyronitrile)を仕込み、蓋を閉めず窒素雰囲気のグローブボックスに10分間静置することで圧力ガラス容器内の空気を窒素置換した。窒素で置換した後蓋を閉め、80 ℃にて15時間インキュベーター内で振盪させることで重合反応を進行させた。得られた反応混合物をdiethyl ether 200 mLに加えて沈殿させた。デカンテーションにより上層の溶液を除去した後、沈殿物を再度ethanol 20 mLに溶解した後hexane 200 mLに加えることで再沈殿精製を行った。回収物を40 ℃で減圧乾燥し1.79 gの白色固体(収率89.7%)を得た。
3.1.2. 生体親和性の評価
各ポリマーの生体親和性の評価としてタンパク質吸着量をmicro-BCA法を用いて解析した(14)。
まずpolypropylene製の96 wellのマイクロプレート上にethanolで0.2 wt / vol%に調製した各ポリマー溶液を15 µLずつ滴下し、室温で3日間以上乾燥することでポリマーコーティングプレートを作製した。作製したプレート上に濃度 1.0 mg/ mLのフィブリノーゲン水溶液を50 µLずつ滴下し、37 ℃で10分間インキュベートした。10 分後PBS(リン酸緩衝食塩水)で洗浄操作を行い、5% SDS (Sodium Dodecyl Sulfate)と0.1 N NaOHを混合した溶液を30 µLずつ滴下し、37 ℃で1時間インキュベートした。種々のタンパク質濃度に調製したサンプルにより検量線を作成し、調製したmicro-BCA溶液を150 µLずつ滴下した後、37 ℃で2時間インキュベートした。2時間後、発色したサンプルを562 nmの波長の吸光度をマイクロプレートで測定し、各基板上へ吸着したタンパク質の量を定量化した。フィブリノーゲン溶液を加える前に、1日間PBSでプライミング(水和)処理した結果と併せてFig, 4に示す。
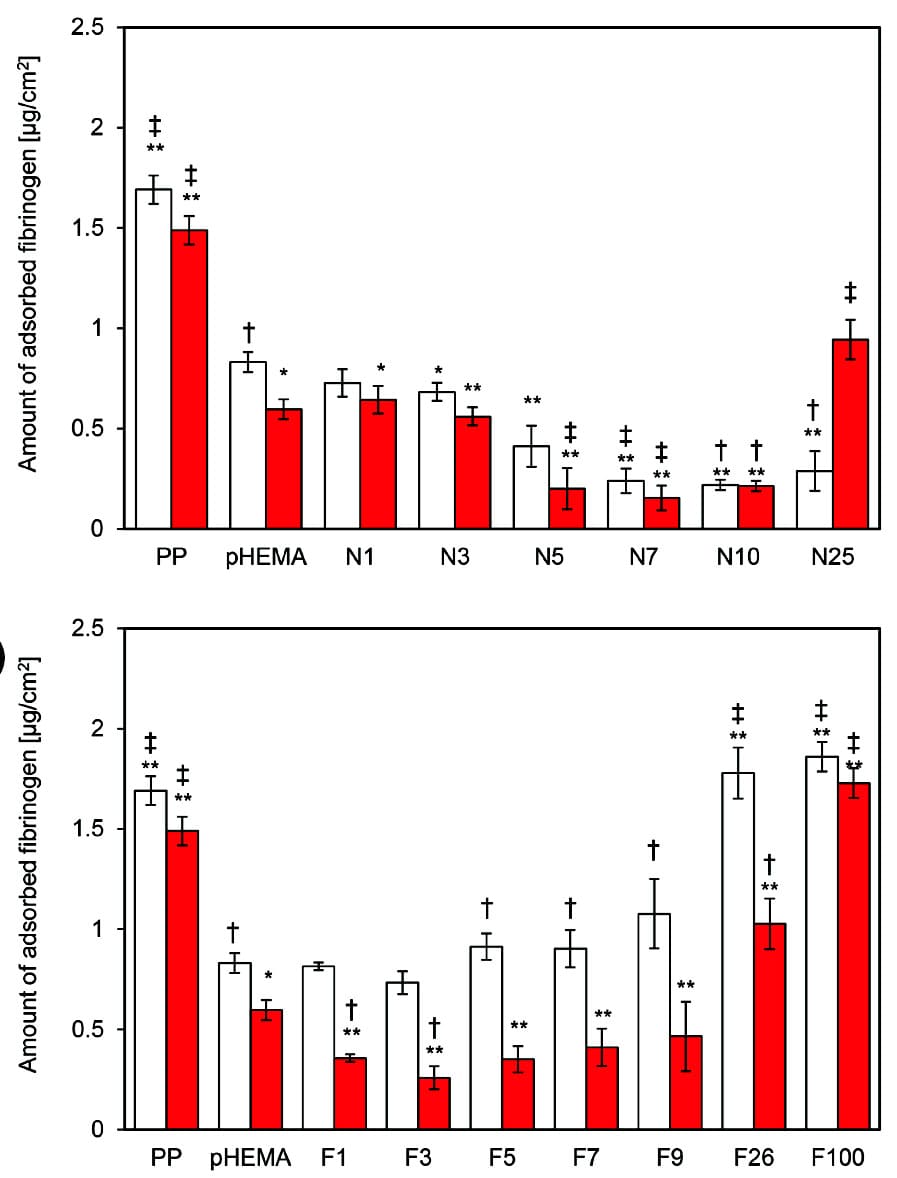 Fig. 4 The amount of fibrinogen adsorption onto the surface of N-series (a) and F-series (b) using surfaces without (white bar) or with priming (red bar). The data represent the means ± SD (n = 3) of fibrinogen adsorption. The significance of the differences between two samples was determined using an unpaired Student’s t-test using Microsoft Excel. Differences with P values less than 0.05 were statistically significant. †: P < 0.05, **: P < 0.01 vs. PHEMA without priming and †: P < 0.05, ‡: P < 0.01 vs. PHEMA with priming substrate.Reprinted with permission from [13], Copyright © 2020, American Chemical Society
Fig. 4 The amount of fibrinogen adsorption onto the surface of N-series (a) and F-series (b) using surfaces without (white bar) or with priming (red bar). The data represent the means ± SD (n = 3) of fibrinogen adsorption. The significance of the differences between two samples was determined using an unpaired Student’s t-test using Microsoft Excel. Differences with P values less than 0.05 were statistically significant. †: P < 0.05, **: P < 0.01 vs. PHEMA without priming and †: P < 0.05, ‡: P < 0.01 vs. PHEMA with priming substrate.Reprinted with permission from [13], Copyright © 2020, American Chemical Society得られたHEMAコポリマーのフィブリノーゲンの吸着量は、異種モノマーが少量(3~7 mol%)の特定組成比において極小値を示した。DMAEMAは親水性ではあるが電気的には中性ではなく、TFEMAは電気的には中性ではあるが疎水性を示す。そのため得られたHEMAコポリマーの生体親和性は化学構造から考えると、2.1に記載したWhitesideらの報告より悪化することが予想される一方、Kikuchiら、Zhaoらの先行研究とは同様の傾向を示した。そのため、本ポリマーの生体親和性は化学構造ではなく水和構造と相関性が高いと推察される。
3.1.3. バルクの水和構造の評価
得られたポリマーについて、含水状態の水和構造を解析するためDSC測定を行った。サンプルは3日以上水和させた後、3 mgから8 mgを採取して分析試料とし、あらかじめ質量を測定したアルミパンの底に薄く広げ蓋を閉めたのち1日以上静置した。窒素流量50 mL/分、5.0 ℃ /分の条件で以下に示す温度プログラムで測定を実施した。
- 30 ℃から50 ℃まで加熱
- 50 ℃から-80 ℃まで冷却
- 5分間保持
- -80 ℃から50 ℃まで加熱
- 50 ℃から30 ℃まで冷却
この温度プログラムを用いて降温および昇温カーブを取得し、吸発熱量を評価した。測定後にアルミパンにピンホールをあけて試料を110 ℃で3日以上真空乾燥させて質量を測定し、乾燥前後の試料の質量から含水量を求め、式1から試料の含水量(Wc: wt%)を算出した。
Wc=((W1-W0) / W1) × 100 (式1)
ここで、W0は乾燥後の試料の質量であり、W1は乾燥前の試料の質量である。また、以下に示す降温および昇温カーブにおける低温結晶形成および融解の熱量を算出し(式2)~(式4)を用いて、各水の定量化を行った。
- EWC=NFWC + IWC + FWC (式2)
- IWC=(ΔHcc / 334(J / g) (式3)
- FWC=(ΔHm / 334(J / g)) - IWC (式4)
- NFWC=EWC - IWC - FWC (式5)
上記をそれぞれ、
- ΔHcc:降温と昇温過程の水の低温結晶化熱量(J / g)
- ΔHm:氷の融解熱量(J / g)
- EWC:飽和含水量(wt%)
- NFWC:不凍水量(wt%)
- IWC:中間水量(wt%)
- FWC:自由水量(wt%)
と定義した。
各コポリマーの飽和含水量はDMAEMAが共重合されると増加し、TFEMAが共重合されると減少した。それぞれHEMAよりも親水性および疎水性を示す各モノマーの特性が反映され加成性を示す結果となった。一方、各含水量は最大約10 mol%の範囲で相加的には変化しなかった。この範囲において、N-seriesは運動性の低い不凍水量が減少し運動性の高い自由水量が増加した。逆に、F-seriesは不凍水量と中間水は若干増加し自由水量は減少した。(Fig. 5)
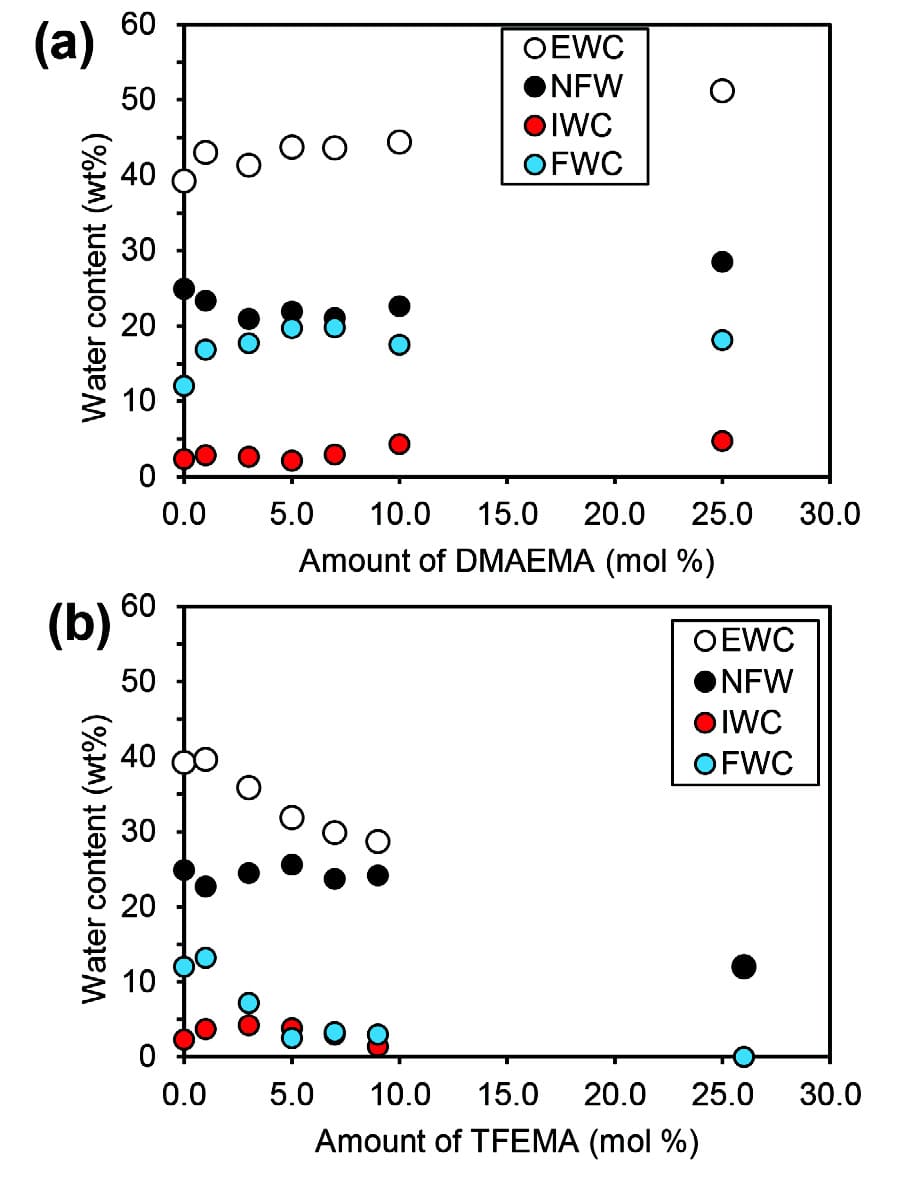 Fig. 5 Dependence of the water content on the amount of the introduced(a) DMAEMA and(b) TFEMA at EWC. Reprinted with permission from [13], Copyright ©2020, American Chemical Society
Fig. 5 Dependence of the water content on the amount of the introduced(a) DMAEMA and(b) TFEMA at EWC. Reprinted with permission from [13], Copyright ©2020, American Chemical Society水和構造の特異的な変化を考察するため、飽和含水状態の水の運動性とポリマーの運動性に着目した。水の運動性は、含水させたサンプルに磁場強度20 MHzで100 msecパルス照射し、得られたデータをフィッティングして算出したNMRの緩和時間(T2)で評価した。ポリマーの運動性はDSCから算出したガラス転移温度(Tg)で評価した。T2はPHEMAと比べるとN-seriesで大きくなり、F-seriesでは小さな値を示した。一方、飽和含水状態のTgはPHEMAと比べるとN-seriesで低くなり、F-seriesでは高い値を示した。(Fig. 6)
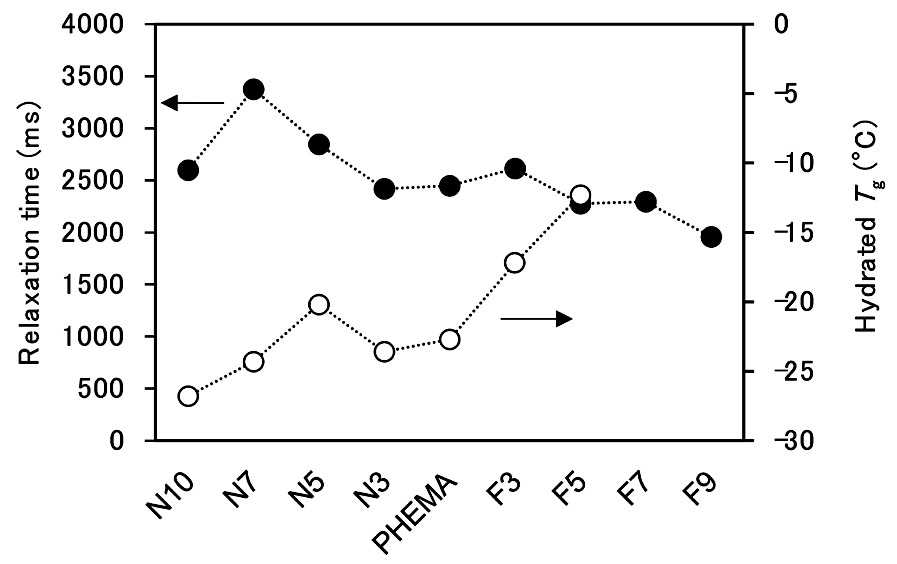 Fig. 6 Relaxation time of water (T2) and hydrated Tg of the HEMA copolymers.Reprinted with permission from [13], Copyright © 2020, American Chemical Society
Fig. 6 Relaxation time of water (T2) and hydrated Tg of the HEMA copolymers.Reprinted with permission from [13], Copyright © 2020, American Chemical Society以上の結果より、HEMAに少量のDMAEMAを共重合させると、HEMAと強く相互作用する水、つまり不凍水の一部が-NCH3基との相互作用に変化する。その結果、HEMAと水間の水素結合ネットワーク構造が緩み、不凍水の一部が中間水または自由水に変化し、水和水全体の運動性も高まったと考えられる。逆に、HEMAに少量のTFEMAを共重合すると、HEMAと弱く相互作用している水、つまり自由水の一部が-CF3基から遠ざかるために、HEMAの親水部により近づき、HEMAと水間の水素結合ネットワーク構造が強化され、自由水の一部が中間水に変わるとともに水和水の運動性も低下したと考えられる。(Fig. 7)
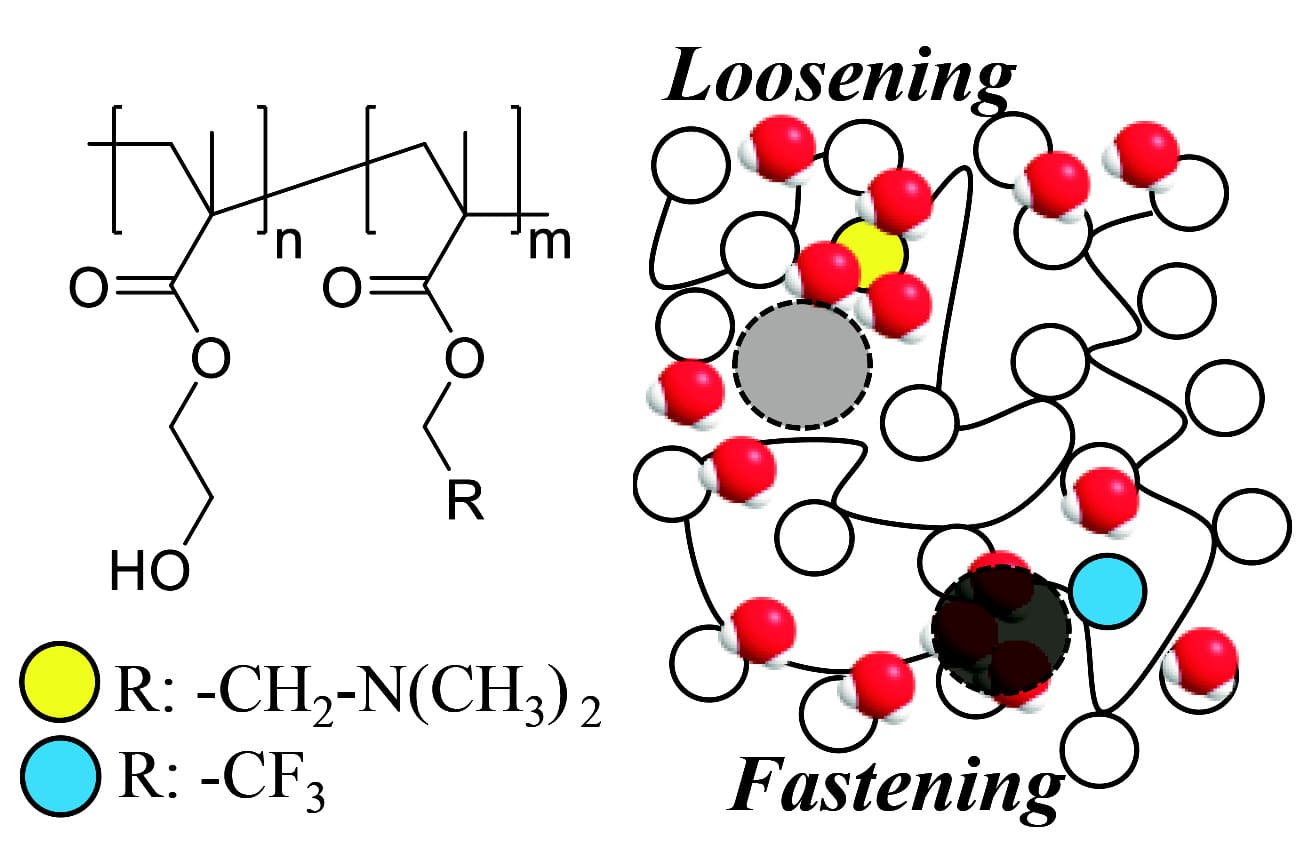 Fig. 7 Schematic diagram of the hydration structure of the HEMA copolymers.
Fig. 7 Schematic diagram of the hydration structure of the HEMA copolymers.PHEMAは含水量が高く水和構造の変化を観察しやすいが、生体親和性はPMEAやPMPCと比べると必ずしも高くない。そこで、次章ではマトリックスポリマーをより生体親和性に優れたPMEAに変更し、共重合するモノマーの運動性を変化させたポリマーを合成し、水和構造との関係を調査した結果を述べる。
3.2. MEA共重合体(15)
3.2.1. 合成とバルクの水和構造
分子運動性に着目し2種類のフッ素含有PMEAを合成した。TFEMAを低分子量で重合したマクロモノマ ーおよび2-Bromoisobutyric Acid Ethyl Esterと1H,1H-Perfluoro-1-octanolとを反応させたエステルを開始剤としてMEAを重合し、PTFEMA-b-PMEA、 F15-PMEAを得た。TFEMAは4量体にすることで70 ℃付近にTgを有し、室温では固体である。一方、F15は室温で液体であるためそれぞれSolid F-PMEAおよびLiquid F-PMEAとした。分子量を制御することで導入するフッ素量を5.5 wt%で統一した。Fig. 8に化学構造とTable 1にDSCで評価した水和構造を示す。
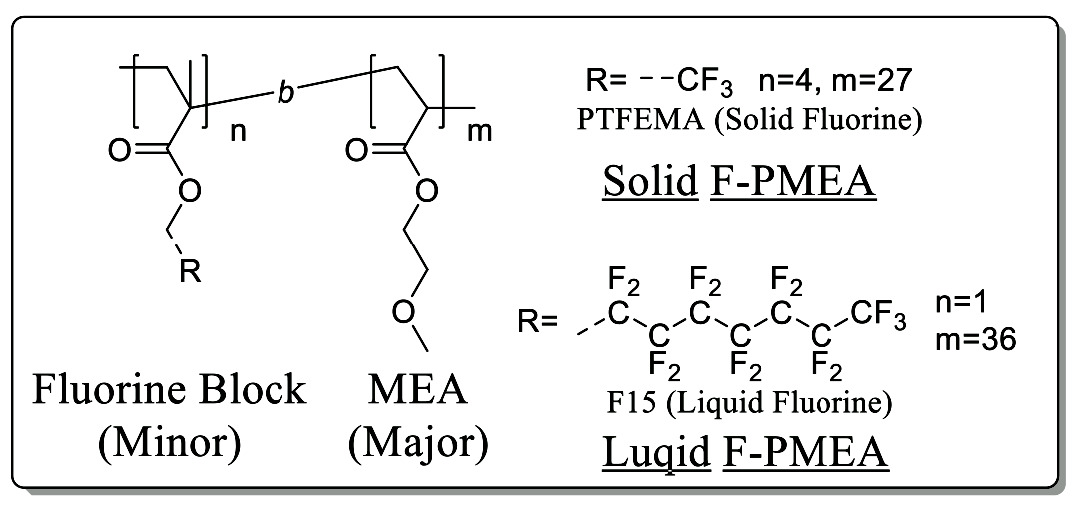 Fig. 8 Chemical structures of F-PMEAs.
Fig. 8 Chemical structures of F-PMEAs.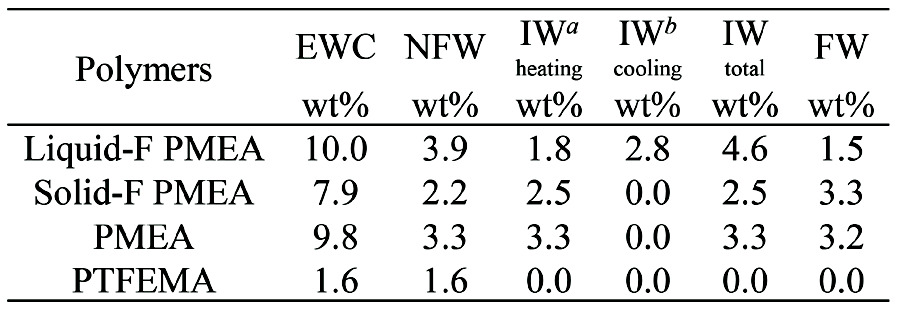 a Fluorine content was calculated using the theoretical Mn value. The wt% was calculated from the wt. ratio of the fluorine atoms in the polymer. b Mn theo was calculated from the block copolymer composition identified by 1H-NMR.Reprinted with permission from [15], Copyright © 2019, American Chemical Society
a Fluorine content was calculated using the theoretical Mn value. The wt% was calculated from the wt. ratio of the fluorine atoms in the polymer. b Mn theo was calculated from the block copolymer composition identified by 1H-NMR.Reprinted with permission from [15], Copyright © 2019, American Chemical SocietyLiquid-F PMEA、Solid-F PMEAとPMEAはそれぞれ約-40 ℃で水が低温結晶形成し、0 ℃以下で融解する中間水の存在が確認された。PMEAセグメントの効果であると考えられる。Liquid-F PMEAはPMEAよりも不凍水量が多く自由水量が少ない。3.1でHEMAに少量のTFEMAをランダム共重合することで、自由水が不凍水と中間水へ変化すると結論した。マトリックスポリマーがPMEAの場合でも同様の傾向を示した。一方、ブロックポリマーであるSolid-F PMEAは傾向が異なる。フッ素の導入によりPMEAよりも不凍水量と中間水量が低下している。これはフッ素セグメントとPMEAセグメントとで水和構造の加成性が成立し、飽和含水量とともに低下したためと考えられる。自由水量だけはPMEAと同程度を維持している。フッ素セグメントが水和下で凝集した際、PMEAホモポリマーとは相互作用していなかった水の一部が疎水性水和を形成し、自由水として検出されたためと考えられる。
3.2.2. 生体親和性とバルクの水和構造との相関
生体親和性の評価として血小板の粘着試験を行った。PET基板のポリマーをコーティングし、8 mm四方にカットし、SEM 台に固定したものを試験に用いた。まず、ヒト全血から 1500 rpmで5分間遠心分離を行い、多血小板血漿(PRP; Platelet Rich Plasma)を回収した。PRPを回収後、4000 rpmで10分間遠心分離を行い、少血小板血漿(PPP; Platelet Poor Plasma)を回収した。回収したPRPとPPPを用い、血小板の播種密度が 4.0 × 107 cells/cm2 となるように血小板懸濁液を調製した。調製した血小板懸濁液は、各ポリマー基板上へ200 µLずつ播種し、37 ℃で1 hインキュベートした。インキュベート後、PBSで各基板を洗浄し、1%グルタルアルデヒド溶液中に2 h浸漬させることで基板上に粘着した血小板を固定した。固定後、①PBS、②PBS : 純水=1 : 1、③純水 × 2 の順番で洗浄し、24 h以上風乾した。風乾した各ポリマー基板は、1基板辺り5点ずつSEM観察を行い、血小板の粘着数をカウントした。プライミングはPBSで行った。フィブリノーゲン吸着試験の結果と併せて中間水量との相関をFig. 9にまとめた。なおそれぞれ1時間プライミング処理した結果も併記する。
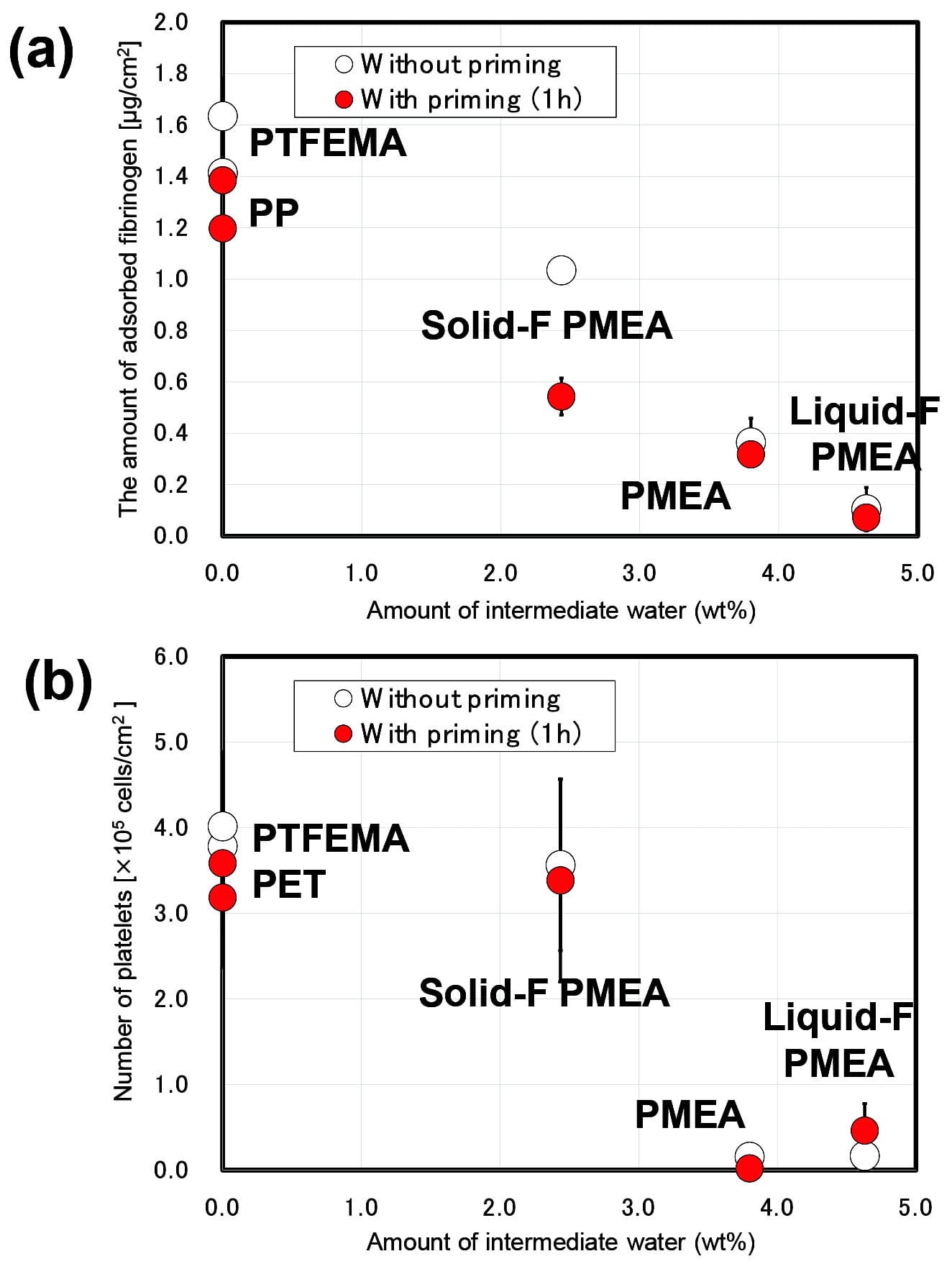 Fig. 9 Amount of fibrinogen adsorption (a) and human platelet adhesion (b) onto the surface of F-polymers and PET using surfaces without or with priming. The data represent the means ±SD (n = 3) of fibrinogen adsorption and denaturation and ±SD (n = 11) of the platelet adhesion.Reprinted with permission from [13], Copyright © 2019, American Chemical Society
Fig. 9 Amount of fibrinogen adsorption (a) and human platelet adhesion (b) onto the surface of F-polymers and PET using surfaces without or with priming. The data represent the means ±SD (n = 3) of fibrinogen adsorption and denaturation and ±SD (n = 11) of the platelet adhesion.Reprinted with permission from [13], Copyright © 2019, American Chemical Society先行研究同様、中間水量の増加とともに生体親和性は向上する傾向を示した。この傾向はプライミング後に顕著であった。特に運動性の低いフッ素ブロックであるPTFEMAが共重合されたSolid-F PMEAでは、プライミングすることでフィブリノーゲンの吸着量抑制効果は大幅に向上している。一方、血小板の粘着数はほとんど変化がなかった。この結果をさらに解釈するためには、水-ポリマー界面近傍の水和構造の変化の評価が重要であると考えられるため、AFMによる表面状態の測定を行い詳細の議論を行う。
3.2.3. 界面の水和構造の評価
Murakamiらによって、PMEAのAFMに関しては報告されておりPBS界面で凹凸形状を形成することが報告されている(16)。本検討でもAFMを用いて形状と弾性率の経時変化を測定した。AFMはCypherおよびカンチレバーHQ–75–Auを用いて測定を行った。なおカンチレバーは、空気中でのばね定数k=2.5 N / m、共振周波数f=75 kHz、先端半径<10 nmで、ACモードによるトポグラフィーをPBS中で画像化した。乾燥状態の並びにPBS中に浸漬してから10、30、および60分後サンプルの算術平均高さ(Sa)を画像から算出した。弾性率はフォースカーブの押し込み過程から得られる曲線を解析し、最大応力に対して20~80%の領域をDerjaguin-Muller-Toporovモデルにより解析した(17)。Fig. 10に乾燥状態とPBSに10分、30分および60分浸漬した後のそれぞれのポリマーの形状測定の結果を、Table2に乾燥状態とPBSに60分浸漬した算術平均高さ(Sa)と弾性率の結果をまとめる。
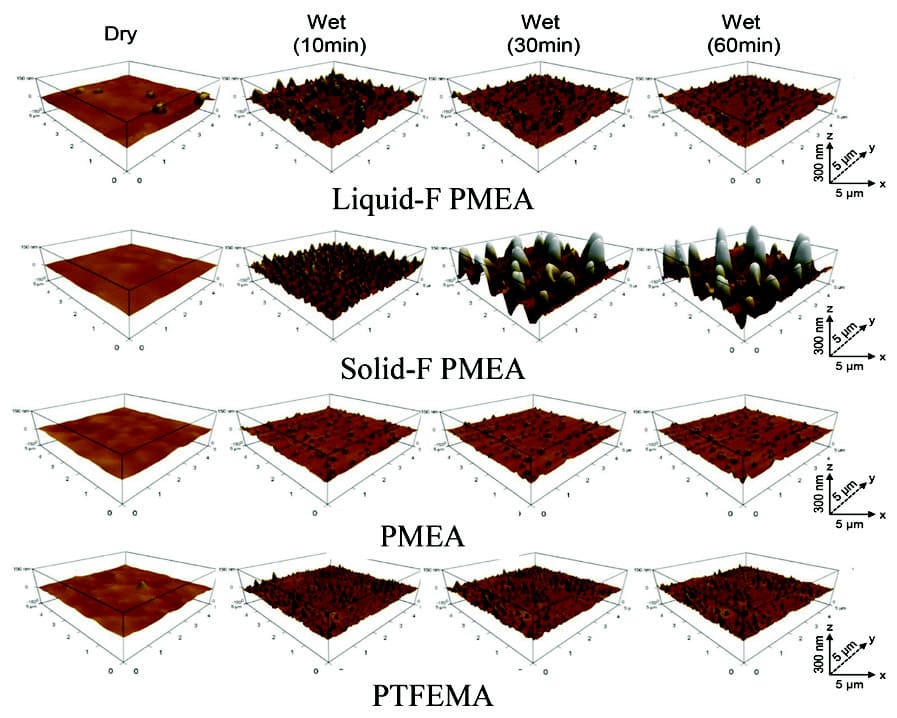 Fig. 10 AFM topographic images of F-PMEAs / PBS interfaces in dry and hydration structure (10, 30 and 60 minutes after dropping the PBS).Reprinted with permission from [13], Copyright © 2019, American Chemical Society
Fig. 10 AFM topographic images of F-PMEAs / PBS interfaces in dry and hydration structure (10, 30 and 60 minutes after dropping the PBS).Reprinted with permission from [13], Copyright © 2019, American Chemical Society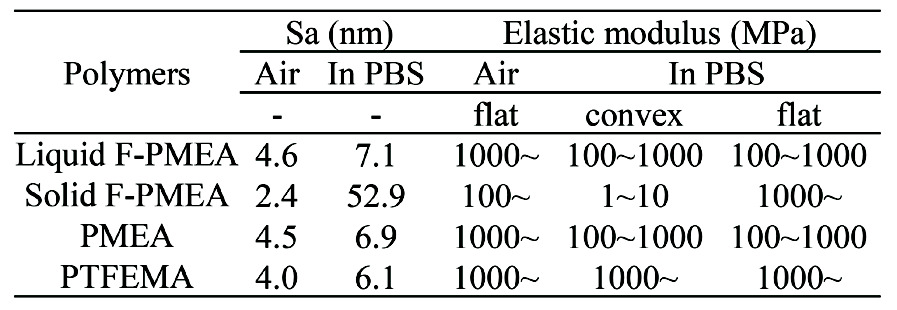
乾燥状態では全てのサンプルは平らであり、Saは約5 nmである。プライミング後30分と60分に大きな違いはないので、形態変化は30分以内に飽和すると考えられる。一方、Solid-F PMEAのみ大きな凹凸構造を形成し、凹部と凸部で弾性率が2~3桁異なる。
また、Solid-F PMEAに水滴を滴下した際の接触角は、水滴下直後は94.7°であったものが30秒後には89.0°と経時的に親水化した。この結果は、Solid-F PMEAは緩やかなに表面再配向により界面分子がPTFEMAからPMEAへ切り替わることが示唆している。一方、水中の気泡接触角は124.1°とLiquid-F PMEA(129.3°)やPMEA(130.6°)と比べると相対的には疎水性を示していた。この結果と併せて考えると、Solid-F PMEAは空気との界面ではPTFEMAセグメントが凝集しているが、水との接触により表面張力のミスマッチを補うために、内部からPMEAセグメントが押し出され凸部分が形成される。しかし、PTFEMAセグメントはTgが高いために完全にPMEAセグメントと切り替わるわけではなく凹部分にはある一定の割合留まっている。そのためSolid-F PMEAの生体親和性に関しては以下のようにまとめることができる。プライミングすることで親水部のPMEAセグメント凸部として水界面に形成されることで大きさが数10 nm程度のフィブリノーゲンの吸着は抑制することができる。しかし、血小板は2 µm程度の円盤状の血球細胞であるため凹部に残っている1µm程度の疎水部のPTFEMAセグメントを足場にして粘着し、プライミング前後で粘着数が大きな変化がなかった可能性がある。(Fig. 11)
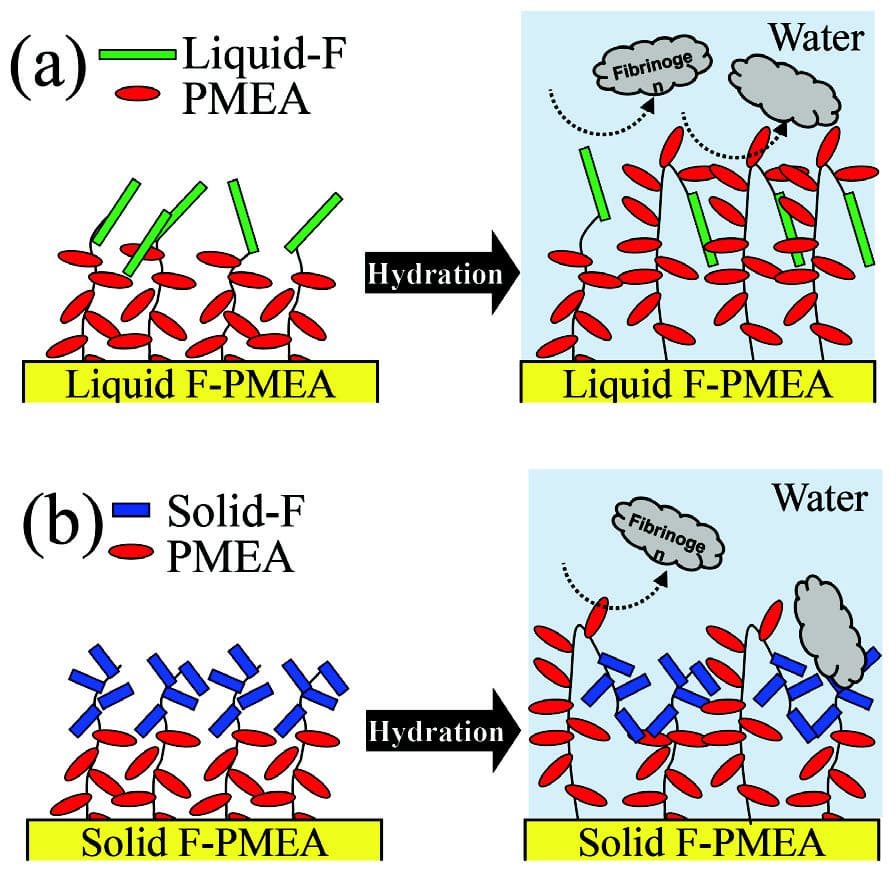 Fig. 11 The conceptual images of F-PMEAs in dry and hydration structure that suppresses fibrinogen: (a) Liquid F-PMEA and (b) Solid F-PMEA.Reprinted with permission from [13], Copyright © 2019, American Chemical Society
Fig. 11 The conceptual images of F-PMEAs in dry and hydration structure that suppresses fibrinogen: (a) Liquid F-PMEA and (b) Solid F-PMEA.Reprinted with permission from [13], Copyright © 2019, American Chemical Society4. 総括
本検討では水和構造を制御し優れた生体親和性材料を開発することを目的に、異種モノマーが少量共重合されたPHEMAとPMEAを分子設計し生体親和性を評価した。
このコポリマーをコーティングして得られた薄膜は先行研究と同様に、異種モノマーの割合が少量である場合にフィブリノーゲン吸着量が極小値を示すことを確認した。DSC測定による含水状態のポリマーの水和構造とガラス転移温度および固体NMRによる水の緩和時間の測定結果から、共重合する異種モノマーがアミノ基の場合はポリマーと強く相互作用している不凍水が、トリフルオロメチル基の場合は弱く相互作用している自由水がそれぞれ中間水にシフトすると考察した。中間水量の増加が生体親和性の向上の一因であると結論した。マトリックスポリマーがHEMAなどのように水酸基を有し不凍水量が多い場合は親水的なモノマーを、PEGやPMPCのように自由水量が多いポリマーに関しては疎水性なモノマーを少量共重合することで選択的に中間水量を増やせる可能性が示唆され、新規な水和構造の制御方法の提案を行った。
また更なる生体親和性向上のためにマトリックスポリマーをPMEAに変更して、界面の水和構造に着目した。導入するフッ素元素の質量比を統一し、分子運動性が生体親和性と水和構造に与える影響を評価した。分子運動性が高いフッ素含有開始剤と共重合したPMEAは、PMEAと比べて生体親和性に優れていることを明らかにした。これらの結果より、優れた生体親和性界面を構築するためには、十分な中間水を含む鎖が効率的に水界面に配向する必要があると考えられる。
これらのコンセプトを使用した材料はATGの培養容器であるEZSPHERER-SPのコーティング材料として上市されており、再生医療の普及と共に拡大されること期待される(18)。また医療機器の高寿命化、診断機器のS/N比の向上など様々な分野への応用が期待される。
5. 謝辞
本研究は私が九州大学での社会人博士課程時代に検討した内容であり、私を指導してくださった田中賢教授および田中研究室メンバーに謝意を表します。また本研究はデンマーク工科大学 Katja Jankova先生と共同で行われました。議論や論文執筆に多くの時間を割いていただきました。深く感謝の意を表します。
参考文献
- 経済産業省における 医療機器産業政策について https://www.med-device.jp/repository/other/201809-meti-seisaku.pdf
- Mori, Y.; Nagaoka, S.; Takiuchi, H.; Kikuchi, T.; Noguchi, N.; Tanzawa, H.; Noishiki, Y. Trans. Am. Soc. Artif. Internal Organs. 1982. 28, 459-463.
- Martins, M.; Wang, D.; Ji, J.; Feng, L.; Barbosa, M. Biomaterials 2003, 24(12), 2067−2076.
- Kadoma Y.; Nakabayashi N.; Masuhara E.; Yamauchi J. Kobunshi Ronbunshu, 1978 35, 423-427.
- Ishihara K.; Ueda T.; Nakabayashi N. Polym. J. 1990, 22, 355-360.
- Ostuni, E.; Chapman, R. G.; Holmlin, E.; Takayama, S.; Whitesides, G. M. Langmuir 2001, 17, 5605−5602.
- Holmlin, E.; Chen, X.; Chapman, R. G.; Takayama, S.; Whitesides, G. M. Langmuir 2001, 17, 2841−2850.
- Tanaka, M.; Motomura, T.; Kawada, M.; Anzai, T.; Kasori, Y.; Shiroya, T.; Shimura, K.; Onishi, M.; Mochizuki, A. Biomaterials 2000, 21(14), 1471−1481.
- Tanaka, M.; Motomura, T.; Kawada, M.; Anzai, T.; Kasori, Y.; Shimura, K.; Onishi, M.; Mochizuki, A.; Okahaya, Y. Jpn J Artif Organs 2000, 29, 209-216.
- Kikuchi, A.; Karasawa, M.; Tsuruta, T.; Kataoka, K. J. Colloid Interface Sci . 1993, 158, 10-18.
- Tsuruta, T. J. Biomater. Sci. Polym. Ed. 2010, 21, 1831–1848.
- Zhao, Z.; Ni, H.; Han, Z.; Jiang, T.; Xu, Y.; Lu, X.; Ye, P. ACS Appl. Mater. Interfaces, 2013, 5, 7808−7818.
- Koguchi, R. Jankova, K. Hayasaka, Y. Kobayashi, D. Amino, Y. Miyajima, T. Kobayashi, S. Murakami, D. Yamamoto, K. Tanaka, M. ACS Biomater. Sci. Eng. 2020,6(5), 2855-2866.
- Sato, K.; Kobayashi, S.; Kusakari, M.; Watahiki, S.; Oikawa, M.; Hoshiba, T.; Tanaka, M. Macromol. Biosci. 2015, 15(9), 1296−1303.
- Koguchi, R.; Jankova, K.; Tanabe, N.; Amino, Y.; Hayasaka, Y.; Kobayashi, D.; Miyajima, T.; Yamamoto, K.; Tanaka, M. Biomacromolecules 2019, 20 , 2265-2275.
- Murakami, D.; Kobayashi, S.; Tanaka, M. ACS Biomater. Sci. Eng. 2016, 2(12), 2122–2126.
- Derjaguin, B. V.; Muller V. M.; Toporov, Y. P. J. Colloid. Interf. Sci. 1975, 53, 314.
- http://iwaki.atgc.co.jp/div/rika/hbin/ez2012_a.html