AGC Research Report 74(2024)
ガラス中Ce(Ⅳ)定量法
Ce(Ⅳ)determination method in glass
竹中敦義*
Atsuyoshi Takenaka
*AGC株式会社 先端基盤研究所(atsuyoshi.takenaka@agc.com)
セリウム(Ce)は色消し剤、UV吸収剤としてガラスに添加されることがある。Ceはガラス中で+ 3価、+ 4価の価数を取り、目的に応じて価数制御が必要である。Ce価数の評価法として通常の実験室で実施可能な手法として、吸光度法と化学分析法が考えられる。ガラスを固体のまま測定できる吸光度法は、ガラス中のCe(Ⅲ)、Ce(Ⅳ)の吸光係数がないと適用できないため、化学分析で価数別定量して吸光係数を算出する必要がある。よって、いずれにしても化学分析による価数別定量法の確立が必要である。化学分析の前処理でガラスをフッ酸溶解して水溶液化する際に、Ceは難溶性のCeF3、CeF4沈殿を生成して分析用試薬と反応しなくなる問題がある。そこでガラスをフッ酸溶解した後、難溶性沈殿を溶解する前処理法を検討した。価数別定量法として酸化還元滴定でCe(Ⅳ)を定量するには、Ce(Ⅳ)量が十分多量に存在しなくてはならず、必要試料量が大きくなる可能性がある。そこで少量試料でも高感度で選択的にCe(Ⅳ)を定量する方法を確立し、ガラス中5 μg/g(ppm)以上のCe(Ⅳ)の定量が可能となった。JIS法に準じて総Ce量を定量すれば、差からCe(Ⅲ)を算出し価数別定量ができる。
Ce is sometimes added to glass as a decolorizing agent and ultraviolet absorber. Ce exhibits valences of +3 or +4 in glass, and it is necessary to control the valence depending on the purpose. Spectrophotometry and chemical analysis are used to evaluate Ce valence in a typical laboratory setting. However, spectrophotometry, which allows the measurement of glass as a solid, can be applied only if Ce(Ⅲ) and Ce(Ⅳ) absorbance coefficients in the glass are known. Therefore, it is necessary to quantify each valence by chemical analysis and calculate the absorbance coefficients. During the pretreatment for the chemical analysis, Ce generates poorly soluble CeF3 and CeF4 precipitates during the dissolution of glass in hydrofluoric acid, which hinders the reaction with analytical reagents. Therefore, we investigated a pretreatment method dissolving the hardly soluble precipitates after dissolving the glass in hydrofluoric acid. To quantify Ce(Ⅳ) using redox titration as a valence-specific quantitative method, a sufficiently large amount of Ce(Ⅳ) must be available for an accurate measurement. Therefore, we established a method to selectively quantify Ce(Ⅳ) with high sensitivity even with small sample amounts. Ce(Ⅳ) of 5 μg/g (ppm) or more can be quantified in glass using this method. If the total amount of Ce is quantified according to the Japanese Industrial Standards, Ce(Ⅲ) can be calculated from the difference between the total Ce and Ce(Ⅳ), enabling valence-specific quantification.
1. 緒言
セリウム(Ce)は色消し剤、UV吸収剤としてガラスに添加されることがある1)。Ceはガラス中で+ 3価、+ 4価の価数を取り、目的に応じて価数制御が必要である。ガラス中のCe価数の評価法として通常の実験室で実施可能な手法として、吸光度法と化学分析法が考えられる。しかし、ガラスを固体のまま測定できる吸光度法は、ガラス中のCe(Ⅲ)、Ce(Ⅳ)の吸光係数がないと適用できない。そのため、吸光度法の標準分析のため少なくとも1回は化学分析を行う必要がある。化学分析の前処理でガラスをフッ酸溶解して水溶液化する際に、Ceは難溶性のCeF3、CeF4沈殿を生成して分析用試薬と反応しなくなる問題がある。そこでガラスをフッ酸溶解した後、Ceの難溶性沈殿を溶解する前処理法の検討が必要である。
水溶液化できた場合、Ce(Ⅲ)イオンは分析化学的に選択的に定量することは困難だが、Ce(Ⅳ)イオンは高い酸化電位(+1.71V)を持ち、さらに紫外域から450 nm程度まで吸収があり320 nmに吸収極大(ε≒3.6×103 AbsM-1cm-1)を持つ。よって濃度が十分に高い場合は酸化還元滴定法、または吸光光度法でCe(Ⅳ)の定量が可能である。
酸化還元滴定法を行う場合、100 ppmのCe(Ⅳ)を含有するガラスを1 g溶解するとCe(Ⅳ)は0.72 μeqとなるが、0.01 N標準液1滴(約50 μL)は0.5 μeqに相当し、標準液2滴で終点を超えてしまう。0.01 N標準液は十分に希薄で、さらに希釈すると終点の変化が小さくなり判定が困難になる。数十ppmレベルのCe(Ⅳ)を測るためガラスを10 g以上溶解するのは現実的ではなく、酸化還元滴定法は適用が難しい。
また、100 ppmのCe(Ⅳ)を含有するガラス100 mgを溶解し10 mlにした場合、溶液中のCe(Ⅳ)は7.2 μMとなり、320 nmにおける吸光度は0.026となる。数十ppmレベルでは吸光度が<0.01となり、低濃度を定量するには感度不足である。
そこで難溶性沈殿を溶解する方法とともに、高感度発色剤を用いて少量試料でも高感度で選択的にCe(Ⅳ)を定量する方法を確立したので報告する。
2. 試薬、器具、装置
2.1. 試薬
- 硫酸、硫酸ジルコニウム4水和物、硝酸ジルコニル2水和物、硫酸アルミニウム、硝酸アルミニウム、ホウ酸、硫酸セリウム(Ⅳ)アンモニウム4水和物は関東化学社製の特級試薬を、フッ酸は電子工業用を用いた。テトラメチルベンジジン(TMBZ)は東京化成工業社製を用いた。純水は超純水(メルクミリポア社製超純水製造機)を用いた。
- 薬液は以下の通りに調製した。(HF以外はすべてガラス容器を用いる)
H2SO4(1+99) 純水約190 mlに濃硫酸(98%)2 mlを加えて純水で200 mlにする。
0.32 g/ml-Zr(SO4)2 Zr(SO4)2・4H2Oを4.0 g量りとりH2SO4(1+99)で10 mlにする。(表示は固形分濃度)
0.26 g/ml-ZrO(NO3)2 ZrO(NO3)2・2H2Oを3.0 g量りとりH2SO4(1+99)で10 mlにする。
0.21 g/ml-Al2(SO4)3 Al2(SO4)3を2.1 g量りとりH2SO4(1+99)で10 mlにする。
0.24 g/ml-Al(NO3)3 Al(NO3)3を2.4 g量りとりH2SO4(1+99)で10 mlにする。
0.2 mg/ml-TMBZ TMBZを4 mg量りとりH2SO4(1+99)で20 mlにする(容器をAl箔で包んで遮光保存)。
100 ppm-Ce(Ⅳ) Ce(NH4)2(SO4)2・4H2Oを47.8 mg量りとりH2SO4(1+99)で10 mlに定容し1000 ppm-Ce(Ⅳ)とする。1000 ppm-Ce(Ⅳ)を1 ml分取しH2SO4(1+99)で10mlにして100 ppm-Ce(Ⅳ)とする。
10 ppm-Ce(Ⅳ) 100 ppm-Ce(Ⅳ)を1 ml分取しH2SO4(1+99)で10 mlにして10 ppm-Ce(Ⅳ)とする。
HF(1+1) 50 %濃フッ酸50 mLに純水50 mLを加える。
4.4 N-HF 50 %濃フッ酸1.53 mlをH2SO4(1+99)で10 mlにする。 - 高純度SiO2 AGC社製合成石英AQをメノウ乳鉢で粉末にして用いた。
- AQ溶解液 AQ粉末1 gをHF(1+1)10 mlで溶解した液
2.2. 器具
容器はポリスチレン(PS)製10 ml試験管、ポリプロピレン(PP)製30 ml容器(蓋付)、PFA製50 ml容器(蓋付)、ガラス製30 mlバイアル瓶を用いた。
分取はエッペンドルフ社製マイクロピペットを用いた。
吸光光度測定用光学セルはポリスチレン製10mmセルを用いた。
2.3. 装置
分光光度計は島津社製UV-1700を用いた。
3. 実験操作
3.1. Ce(Ⅳ)標準液+TMBZの検量線
ガラスバイアル瓶11個にH2SO4(1+99)をそれぞれ約5 ml加え、10 ppm-Ce(Ⅳ)を0、0.05、0.1、0.3、0.5、1 ml(0~1 ppm用)、100 ppm-Ce(Ⅳ)を0.2、0.4、0.6、0.8、1 ml(0~10 ppm用)加え、0.2 mg/ml-TMBZを0.2 mlずつ加えてH2SO4(1+99)で10 mlに定容する。薬液を光学セルに移して、Ce添加0 mlを参照側セルに入れて分光光度計で450.5 nmの吸光度を測定する。
3.2. 添加剤によるTMBZ発色促進効果
5本のPS試験管にH2SO4(1+99)を5 ml、4.4 N-HFを1 ml、10 ppm-Ce(Ⅳ)を1 ml加え、0.32 g/ml-Zr(SO4)2、0.26 g/ml-ZrO(NO3)2、0.21 g/ml-Al2(SO4)3、0.24 g/ml-Al(NO3)3を1 mlとホウ酸100 mgをそれぞれ加えたのちに0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。別途PS試験管にH2SO4(1+99)を5 ml加え、0.2 mg/ml-TMBZを0.2 mlと10ppm-Ce(Ⅳ)を1 ml加えてからH2SO4(1+99)で10 mlにして参照液とする。
薬液を光学セルに移して、H2SO4(1+99)を参照側セルに入れてTMBZ添加後の吸光度(450.5 nm)の経時変化を、変化が大きい時は2分おき、変化が緩やかなら10分おきに変化がなくなるまで測定する。
3.3. 硫酸ジルコニウム添加量
3本のPS試験管にH2SO4(1+99)を5 ml入れ、0.32g/ml-Zr(SO4)2を0、1、2 mlそれぞれ加えた後、10ppm-Ce(Ⅳ)を1 ml、0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。H2SO4(1+99)を参照側セルに入れて5分後の吸光度(450.5 nm)を測定する。
3.4. 添加剤入り検量線
4本のPS試験管にH2SO4(1+99)を5 ml入れ、10ppm-Ce(Ⅳ)を0.1、0.25、0.5、1 mlそれぞれ加えたのち、0.2 mg/ml -TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。薬液を光学セルに移して、H2SO4(1+99)を参照側セルに入れてTMBZ添加後の吸光度(450.5 nm)の経時変化を測定する。同様にして、0.32 g/ml-Zr(SO4)2を1 ml、ホウ酸100 mgをそれぞれ加えた2系統を調製し、添加剤入りの検量線を作成し、吸光度の経時変化を測定する。
3.5. SiO2+HF共存系経時変化
AQ溶解液を1 ml分取してH2SO4(1+99)を5 ml加え、10 ppm-Ce(Ⅳ)を1 ml、0.32 g/ml-Zr(SO4)2を1ml加えた後、0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。薬液を光学セルに移して、H2SO4(1+99)を参照側セルに入れてTMBZ添加後の吸光度(450.5 nm)の経時変化を測定する。
3.6. Zr添加剤の添加量の影響
3本のPS試験管にAQ溶解液をそれぞれ1 mlずつ分取しH2SO4(1+99)を5 mlずつ加える。0.32 g/ml-Zr(SO4)2を1、1.5、2 ml加えたのち、H2SO4(1+99)で10mlにする。しばらく放置してゲル状シリカの析出状況を観察する。
3.7. TMBZ発色剤の添加タイミング
AQ溶解液を1 ml分取してH2SO4(1+99)を5 ml加え、10ppm-Ce(Ⅳ)を1 ml、0.32 g/ml-Zr(SO4)2を1ml加えたのち、
(i) Zr添加と同時に0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする、
(ii) Zr添加して1時間後に0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする
の2系統でZr添加からの吸光度の経時変化を測定する。
3.8. 発色時の液温の影響
AQ溶解液を1 ml分取してH2SO4(1+99)を5 ml、10ppm-Ce(Ⅳ)を1 ml、0.32 g/ml-Zr(SO4)2を1 ml、0.2mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。混合液を(i)40 ℃、(ii)60~70 ℃に加温した状態で吸光度の経時変化を測定する。
3.9. SiO2+Ceの沈殿遠心分離
PS試験管にAQ粉末0.5 g、1000 ppm-Ce(Ⅳ)0.25ml、HF(1+1)を5 ml加えて放置して溶解する。溶解後、3000 rpm×30分遠心分離して沈殿を試験管の底に集め、上澄み液をできるだけ吸い取り別の容器に移す。沈殿に0.32 g/ml-Zr(SO4)2を5 ml加えて溶解し、1 mlを分取して0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。別の容器の上澄み液を1 ml分取し、0.32 g/ml-Zr(SO4)2を1 ml、0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。沈殿溶解液、上澄み液それぞれの約90分後の吸光度を測定する。
3.10. 溶解温度と容器材質の影響
AQ粉末100 mg、100 ppm-Ce(Ⅳ)0.5 mlをPP容器2個、PFA容器2個にそれぞれ分取してHF(1+1)を1ml加える。PP容器、PFA容器の1組は一晩室温放置し、もう1組は60~70℃で4~5時間加温する。それぞれの溶解時間後にAQ粉末が溶解していることを確認して、0.32 g/ml-Zr(SO4)2を1 ml、0.2 mg/ml-TMBZを0.2 ml加えてH2SO4(1+99)で10 mlにする。約90分後に吸光度を測定する。
PP容器、PS試験管は中性洗剤で洗浄後に水洗~HCl(1+50)酸洗~水洗~乾燥し、PFA容器はHNO3(1+1)浸漬加温~水洗~乾燥して容器を3種類2組用意する。それぞれに10 ppm-Ce(Ⅳ)を1 ml、H2SO4(1+99)を8.8 ml加えて1組はすぐに0.2 mg/ml-TMBZを0.2 ml加えて吸光度を測定し、もう1組は室温で一晩放置し、翌日0.02 % -TMBZを0.2 ml加えて吸光度を測定する。
3.11. 検量線法と標準添加法の比較
PFA容器(30~50 ml)6個を洗剤等で洗浄した後にHNO3(1+1)を満たして70~80℃で3時間加温したのち放冷して水洗~乾燥する。
洗浄済みPFA容器3個にAQ粉末100 mgをそれぞれ量りとり、HF(1+1)を1 ml、100 ppm-Ce(Ⅳ)をそれぞれ0、0.1、0.2 ml加えて一晩放置して溶解する。AQ粉末が溶解したらH2SO4(1+99):5 mlを加えたのち、0.32 g/ml-Zr(SO4)2液:1 ml、0.2 mg/ml-TMBZ:0.2 ml加えて、H2SO4(1+99)で10 mlに定容する。これらを標準添加系列:+0 ppm、+1 ppm、+2 ppmとする。
洗浄済みPFA容器3個にAQ溶解液を1 mlずつ分取して100 ppm-Ce(Ⅳ)をそれぞれ0、0.1、0.2 ml加え、0.32 g/ml-Zr(SO4)2液:1 ml、0.2 mg/ml-TMBZ:0.2 ml加えて、H2SO4(1+99)で10 mlに定容する。これらを検量線系列:0 ppm、1 ppm、2 ppmとする。標準添加系列、検量線系列の吸光度をTMBZ添加して約90分後に吸光度を測定し、濃度(ppm)に対する吸光度の傾きを算出して比較する。
4. 結果と考察
4.1. Ce(Ⅳ)の酸化性発色剤の選択
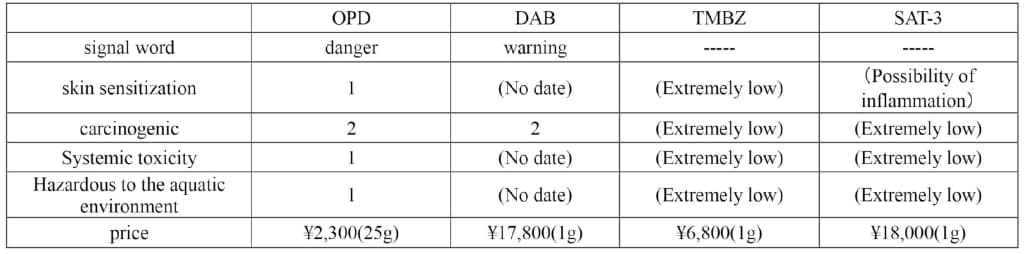
Ce(Ⅳ)の酸化電位(+1.71 V)は過酸化水素の酸化電位(+1.76 V)と同程度なので、バイオ分野でnmol~μmolレベルのペルオキシダーゼ(酸化酵素)や過酸化水素を検出・定量する発色剤をCe(Ⅳ)測定に転用することを試みた。そのような試薬としてオルトフェニレンジアミン(OPD)、ジアミノベンジジン(DAB)、テトラメチルベンジジン(TMBZ)、ビスヒドロキシスルホプロピルトリジン(SAT-3)などがあるが、値段と安全性からTMBZを用いることとした(Table 1)。
4.2. TMBZによるCe(Ⅳ)の検量線
TMBZはFig. 1に示すような構造を持つ酸化系発色剤で、水に溶けにくいが酸にはよく溶ける2)。酸化還元電位(ORP)が+0.88 Vより高いと中性付近で青緑色(λmax = 655 nm)、酸性で黄色(λmax = 450 nm)に発色する。Ce(Ⅳ)濃度に対する検量線をFig. 2に示す。低濃度領域、高濃度領域ともによい直線性がみられる。発色剤を用いることで吸光係数はε≒4.0×104AbsM-1cm-1となり、Ce(Ⅳ)イオン自体の吸光係数3.6×103(320 nm)より約11倍感度が高くなる。0~10μg/mlの高濃度領域では十分に直線と見なせるが、二次曲線で近似すると6点は
Y = -0.00167X2 + 0.2414X + 0.0432 R=1.000
にきれい載る。上に凸の二次曲線なので低濃度側では傾きが若干大きくなるため、測定濃度領域に適した検量線を用いる必要がある。
検量線は0.05 μg/mlまで直線性があり、試料100mgを溶解して10 mlにした場合100倍希釈になるので、ガラス試料中5 μg/g程度までCe(Ⅳ)の定量が可能と考えられる。
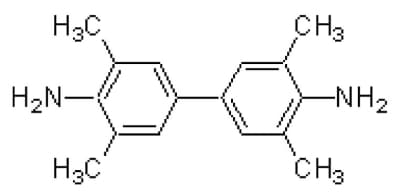 Fig.1 Structural formula of TMBZ
Fig.1 Structural formula of TMBZ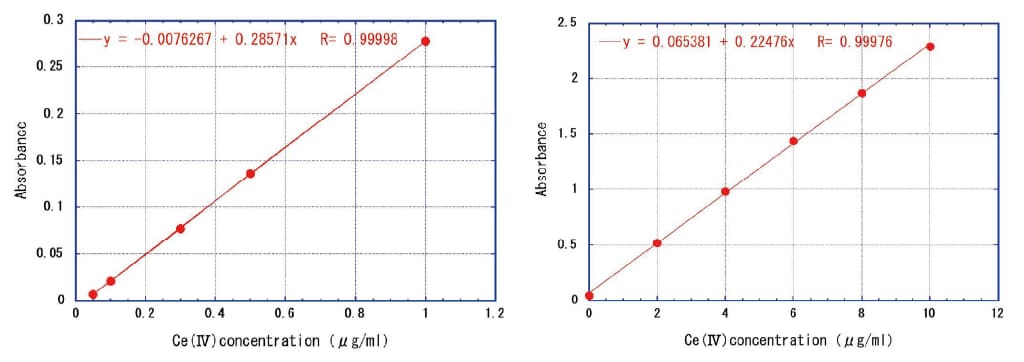 Fig.2 Ce(Ⅳ)+TMBZ calibration curve(left:0.05~1 μg/ml、right:0~10 μg/ml)
Fig.2 Ce(Ⅳ)+TMBZ calibration curve(left:0.05~1 μg/ml、right:0~10 μg/ml)4.3. HF共存下でのTMBZ発色
ガラス溶解にはフッ酸を用いるが、小過剰で添加するため未反応HFが残留する。この未反応HFが共存するとCe(Ⅳ)にTMBZを加えても全く発色しないことが判明した。Table 2に示すようにCe(Ⅲ)、Ce(Ⅳ)はF-と難溶性塩を作り、F-過剰でも可溶性のフルオロ錯体にはならない性質がある3)。CeF4沈殿は極めて難溶性で遊離Ce(Ⅳ)イオンが生じないためTMBZと反応せず発色しない。

4.4. TMBZ発色促進添加剤の選定
Ce(Ⅳ)よりF-と親和性が高いイオンを添加してCeF4からF-を脱離させ、式(1)のようにCe(Ⅳ)が遊離すればTMBZと反応する可能性がある。
CeF4 + Mn+ + 2F- → Ce4+ +[MF6](6-n)- …(1)
そのようなイオンとして、F-配位子の金属錯体生成定数4)5)6)(Table 3)をみるとZr4+、Al3+の錯体生成定数が大きく候補とした。また、HFのマスキングによく用いられるホウ酸も候補に入れた。ホウ酸とF-の錯体生成定数は不明だが、ケイ酸の比色定量(モリブデンイエロー法、モリブデンブルー法)でSiF62-からF-を脱離させる効果としてホウ酸はAl3+の40~50倍モル比が必要と文献7)にあるので、β1≒4.3~4.5程度と推定される。Fe3+も比較的錯体生成定数が大きいが、Fe3+イオンには黄色着色がありTMBZの吸光度測定の妨害になるため採用しなかった。
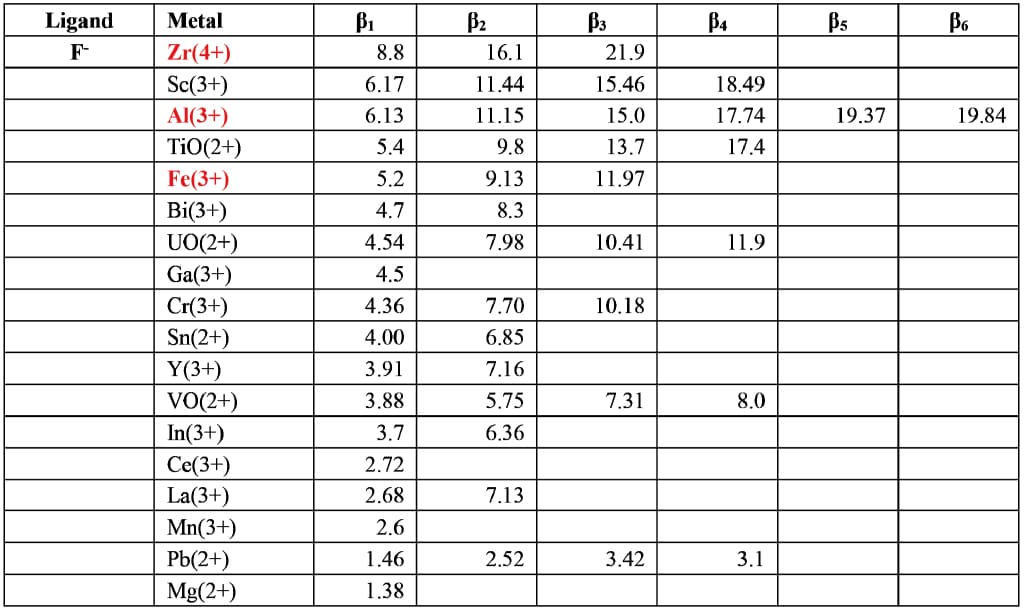
4.5. 添加剤によるTMBZ発色促進効果
4.5.1. 未反応HF共存系
AQ粉末1 g(Si=16.7 mmol)をHF(1+1)10 ml(F=144 mmol)に溶解した場合、Fのうち100 mmolが[SiF6]2-として消費されるので、未反応HFは44mmolとなる。この未反応HFをZr4+、Al3+、B(OH)3でマスキングする必要量は以下のように算出される。
Zr4+ + 6HF→[ZrF6]2- + 6H+ Zr=7.33mmol
Al3+ + 6HF→[AlF6]3- + 6H+ Al=7.33mmol
B(OH)3 + 4HF→BF4- + H+ + 3H2O B =11.0mmol
未反応分のHFが共存したモデル液に発色促進剤を必要量の1.5倍添加した場合の吸光度の時間変化をFig. 3に示す。なおホウ酸は約4%で飽和溶液となるため、フッ酸溶解液1 mlを10 mlに定容する際にホウ酸16.5 mmolを添加するには4%ホウ酸溶液が25.5 mlとなり10 mlに収まらない。よってホウ酸は粉末で100 mgを加え、Zr4+、Al3+は濃厚溶液を添加した。
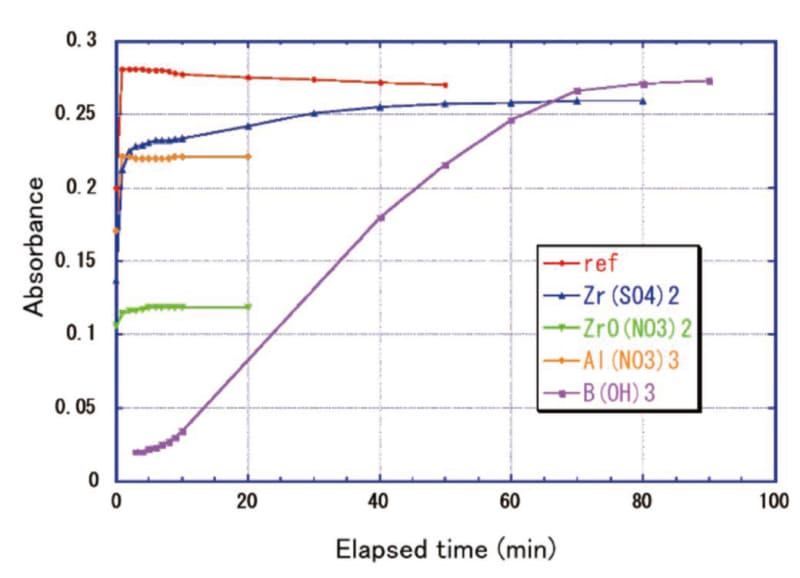 Fig.3 Effect of color development accelerator in HF coexistence system
Fig.3 Effect of color development accelerator in HF coexistence systemFig. 3のref(HF、添加剤なし)の吸光度の経時変化において、発色後10分程度は吸光度を保っているが、それ以降は徐々に褪色することが分かった。30分後で吸光度は約2.5%低下し、Ce(Ⅳ)換算で0.025 μg/ml分となる。試料数が多く発色に時間差がある場合は注意を要する。硝酸ジルコニル(ZrO(NO3)2)、硝酸アルミニウム(Al(NO3)3)は速やかに吸光度が上昇し一定になるがrefの吸光度まで到達しないため、亜硝酸イオンなどの還元性不純物が混入している可能性が考えられる。硫酸アルミニウムは全く発色せず、還元性不純物の混入と考えられる。硫酸ジルコニウム(Zr(SO4)2)は速やかに吸光度が上昇したのち徐々に増加して60分でほぼ一定になった。ホウ酸は添加後から徐々に吸光度が増加し、一定になるには90分以上かかると考えられる。
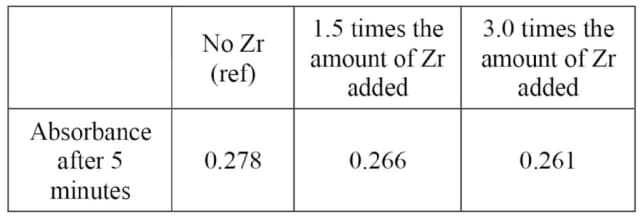
硫酸ジルコニウムを添加した場合、飽和吸光度がrefより若干低いのは①還元性不純物の混入、②マトリックス効果による吸光係数の変化が考えられる。HFなしで硫酸ジルコニウムの添加量を1.5倍量、3.0倍量とした場合の吸光度をTable 4に示す。還元性不純物が原因なら等差間隔で吸光度が低下するはずだが、1.5倍量と3.0倍量はほぼ同じなのでマトリックス効果が原因と考えられる。
検量線への発色促進添加剤の影響をFig. 4に示す。硫酸ジルコニウム、ホウ酸を添加することで検量線の傾きが若干影響を受けている。定量をする際はマトリックス合わせした薬液をベースにして検量線を作成するべきである。
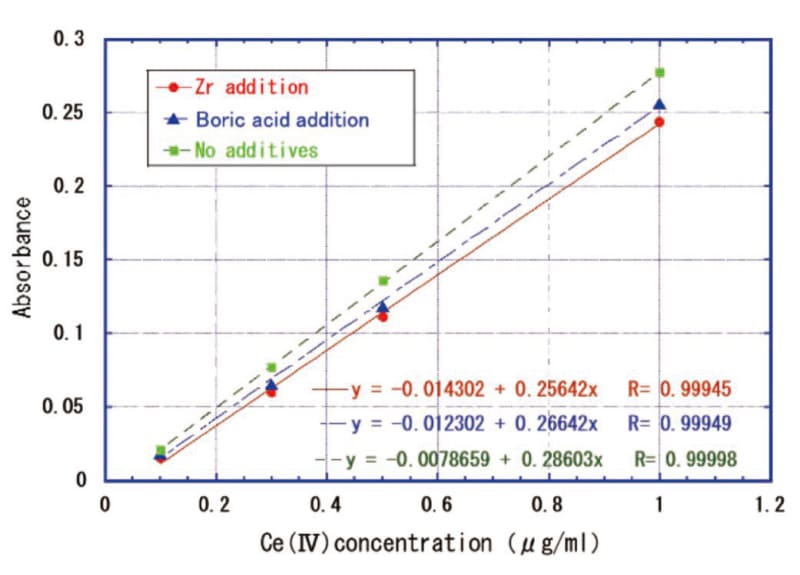 Fig.4 Effect of additives on calibration curve
Fig.4 Effect of additives on calibration curve4.5.2. SiO2+HF共存系
ガラスをフッ酸で溶解すると溶解液中にSiF62-イオンが共存するが、式(2)のようにF-が脱離する平衡によって遊離HFが未反応HFに加わるため、実際のHF濃度は§ 4.5.1.で検討したモデル液より高くなると考えられる。
[SiF6]2- + H2O ⇔[SiF5(OH)]2- + HF …(2)
そこでHF(1+1):10 mlにAQ粉末1 gを溶解した溶解液の10倍希釈液にCe(Ⅳ)を添加し、発色促進剤として硫酸ジルコニウムを添加した場合の吸光度の経時変化を調べた。(ホウ酸は試料ごとに粉末を秤量する手間がかかるため採用しないことにした。)吸光度の経時変化をFig. 5に示す。Ce(Ⅳ)とTMBZは徐々に反応して吸光度は80~90分で飽和した。未反応HFにSiF62-由来のHFが加わることでHF濃度が高くなり、Fig. 3より発色飽和時間が長くなったと考えられる。
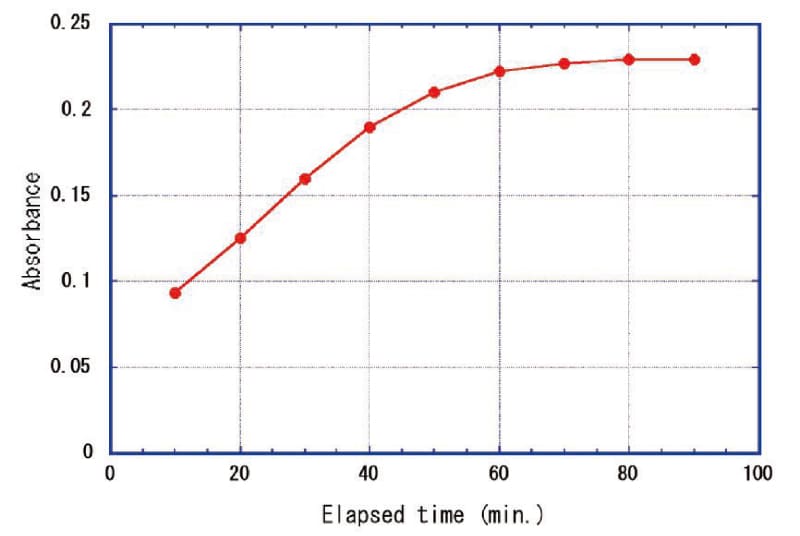 Fig.5 Change in absorbance over time when Zr(SO4)2 is added to SiO2+HF solution
Fig.5 Change in absorbance over time when Zr(SO4)2 is added to SiO2+HF solution4.5.3. 添加剤の添加量の影響
硫酸ジルコニウムの添加量を増やせば発色飽和時間が短くなると考え、Zr添加量を1.5倍、2.0倍にしたが、ゲル状シリカが析出して吸光度測定ができなくなった。ZrのF-親和性がSiより強いため、Zr4+が増えると式(3)のようにSi(OH)4が生成し、それが縮合してゲル状シリカが生成すると考えられる。
SiF62- + Zr4+ + 4H2O → Si(OH)4 + ZrF62- + 4H+ …(3)
4.5.4. TMBZ発色剤の添加タイミング
TMBZは発色後徐々に褪色することが分かったので、Zr4+添加後十分にCe4+イオンが遊離してから発色させた方が発色時間を短縮できて褪色の影響を低減できると考え、Zr4+を添加してから1時間後にTMBZを加えた結果をFig. 6に示す。予想に反して、TMBZを添加してから徐々に発色が進み、Zr4+とTMBZを同時に添加した場合と挙動が変わらないことが判明した。これにより(1)式のようにZr4+添加で定量的に右辺に進むのではなく、(1)’式のように平衡状態が左辺に偏っているのが、右辺の遊離Ce4+がTMBZと反応してCe3+になることで消費され右辺側に平衡が移動し、最終的に全CeF4がTMBZと反応すると考えられる。よってTMBZを添加するタイミングはZr4+添加と同時にした。
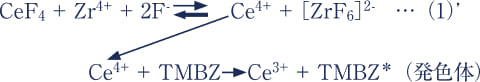
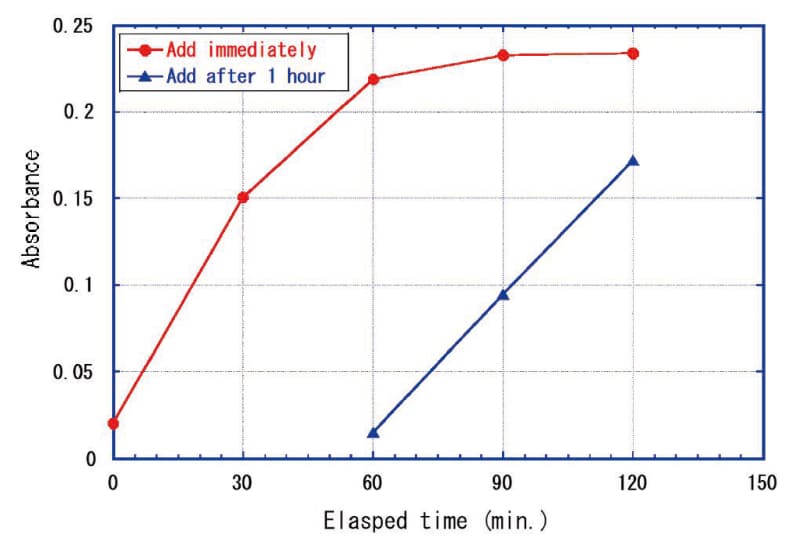 Fig.6 Absorbance change depending on TMBZ addition timing after Zr4+ addition
Fig.6 Absorbance change depending on TMBZ addition timing after Zr4+ addition4.5.5. 発色時の液温の影響
TMBZの発色飽和時間は液温が高いと速くなり、その後の褪色も速いと予想される。実際に60~70℃に加温した場合5~10分で強く黄色発色するが20~30分後には見た目でわかる程度に吸光度が低下した。40℃に保った場合、30分程度で発色の飽和を迎え、その後徐々に褪色が見られた(Fig. 7)。温度が高いと発色体の分解が進みやすいと考えられる。Fig. 6より室温で発色飽和時間が90分程度であれば120分程度までは褪色を無視して吸光度測定ができるため、室温(25℃前後)で試薬添加後90~120分の間に吸光度を測定することとした。
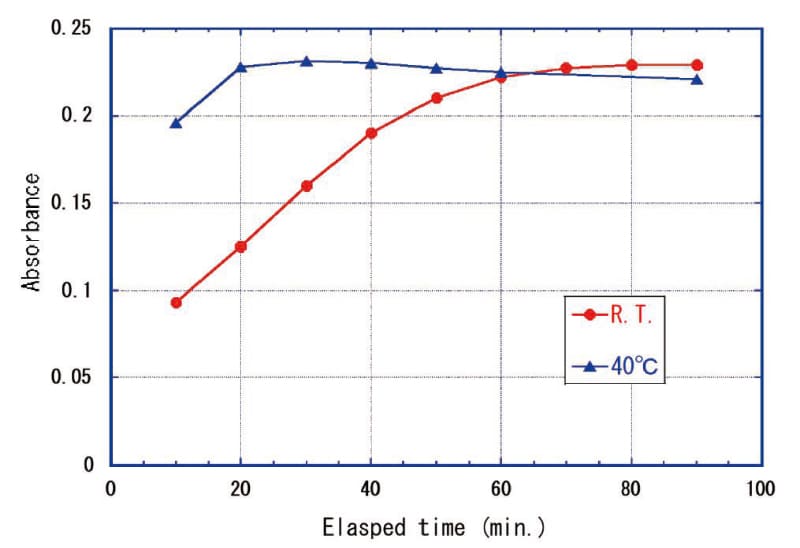 Fig.7 Time dependence of absorbance due to liquid temperature.
Fig.7 Time dependence of absorbance due to liquid temperature.4.6. ガラス試料の分析
4.6.1. ガラス試料の溶解前処理
400~500 μg/gのCeが添加されたガラス試料の粉末1 gにHF(1+1)を10 ml加えて放置し溶解する際に、一晩(~16時間)ではCeF3+CeF4沈殿は目視されないが、一日以上では沈殿が析出してくることが判明した。1~2日放置して十分に沈殿を生成させ、遠心分離で上澄み液を除去して沈殿だけを再溶解すれば、マトリックスとなるHF、H2SiF6が測定液から分離でき単純検量線法で定量できる可能性がある。そこで沈殿分離→再溶解を試みた。
一日半放置して析出した沈殿を遠心分離(3000rpm×30分)で上澄み液と沈殿を分離した。沈殿は硫酸ジルコニウムとH2SO4(1+99)を添加すると容易に溶かすことができ、TMBZで発色できることを確認した。しかし、上澄み液に硫酸ジルコニウムとTMBZを添加すると発色するため、上澄み液にCeF4が一部残留することが判明した。よって沈殿分離するとCe(Ⅳ)全量を測定できないと考えられる。
分取や沈殿分離を行わないでCe(Ⅳ)を全量回収するために、試料粉末100 mgにHF(1+1)を1 ml加えて溶解し、同じ容器内に硫酸ジルコニウム、TMBZ、H2SO4(1+99)を加えて10 mlにすることで、これまでの実験と同じ濃度に調製できる。試料量が少ないとガラス試料内のCe分布にムラがあると測定値のバラツキ要因になるため、試料を多めに採取して均一に粉末化することで試料由来のバラツキを低減する。
4.6.2. 溶解温度と容器材質の影響
ガラス試料粉末にHF(1+1)を加えて一晩放置するのは時間がかかるので、加温して試料の溶解時間の短縮を試みた。発色剤を入れてからの温度は§ 4-5-5で調べたように影響が大きいが、発色剤を添加する前ならば加温してから室温に冷ませば影響ないと予想した。しかし、Table 5に示すようにPP製容器、PFA製容器ともに吸光度の低下が見られた。これは容器の有機素材または有機汚染とCe(Ⅳ)が反応した可能性が考えられる。今までの実験で室温でも突発的に低い吸光度を示す試料があり、これも有機汚染とCe(Ⅳ)が反応している可能性がある。Ce(Ⅳ)は過マンガン酸イオン、重クロム酸イオンよりも酸化電位が高く有機物と反応して消費されると考えられる。ガラス試料100 mgにCe(Ⅳ)が100 ppm含まれていると有機物960 ng(糖類換算)に対応し、有機汚染が極微量の100ngであっても約10 ppm分の吸光度低下につながり誤差要因となる。

有機汚染を洗剤や溶剤で洗った場合、洗剤残りや溶剤中不純物が残留する可能性があり、酸化剤で無機的に有機汚染除去する方が確実と考えられる。PP容器、PS容器は強い酸化剤で表面が酸化劣化するため中性洗剤洗浄~塩酸浸漬洗浄~水洗し、PFA容器はHNO3(1+1)を容器内に満たして70~80℃程度で数時間加熱してからよく水洗したものを用意し、Ce(Ⅳ)溶液とH2SO4(1+99)を入れた直後と1日放置後でTMBZによる吸光度の変化をTable 6に示す。PP容器、PS容器では大きく吸光度が低下しているが、PFA容器は1日後でも低下は微小であった。よってHF分解容器はPFA容器を酸化剤洗浄してから用いることが望ましい。なお、酸化剤で有機汚染除去する場合、過酸化水素+硝酸がよく用いられるが、過酸化水素が残留するとCe(Ⅳ)を還元するため用いないほうがよいと考えられる。
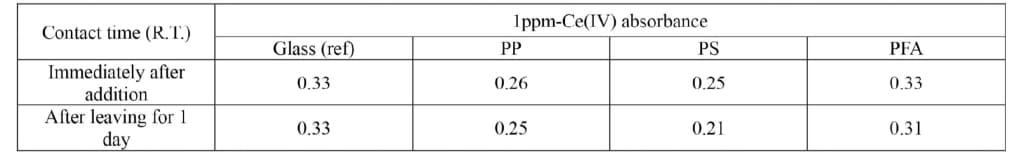
4.6.3. 検量線法と標準添加法の比較
AQ粉末のHF溶解時にCe(Ⅳ)標準液を標準添加して一晩放置したサンプルと、AQ粉末HF溶解液でマトリックス合わせしたCe(Ⅳ)検量線の比較を行った。Ce(Ⅳ)添加量に対する吸光度の傾きをTable 7に示す。一晩の分解を経た標準添加法とマトリックス合わせ検量線法の傾きはほぼ一致し、HF分解操作はCe(Ⅳ)濃度測定に影響しないことが分かった。これにより試料ごとに標準添加法を行う必要はなく、マトリックスを合わせた検量線法で定量することができる。

4.7. 分析操作フロー
前述の検討結果を踏まえて分析フローを以下の通りとした。
- 容器の洗浄:試料数+3個のPFA容器(30~50 ml)を洗剤等で洗浄した後に、HNO3(1+1)を満たして70~80℃で3時間加温したのち放冷して水洗~乾燥する。
- 試料液調製:試料数の洗浄済みPFA容器にガラス試料粉末100 mgをそれぞれ量りとり、HF(1+1)を1 ml、加えて一晩放置して溶解する。試料粉末が溶解したらH2SO4(1+99)を5 mlを加えたのち、0.32g/ml-Zr(SO4)2液:1 ml、0.2 mg/ml-TMBZ:0.2mlを加えて、H2SO4(1+99)で10 mlに定容する。
- 標準液調製:洗浄済みPFA容器3個にAQ溶解液を1mlずつ分取してH2SO4(1+99):5 mlを加えたのち、100 ppm-Ce(Ⅳ)をそれぞれ0、0.1、0.2 ml加え、0.32 g/ml-Zr(SO4)2液:1 ml、0.2 mg/ml-TMBZ:0.2 ml加えて、H2SO4(1+99)で10 mlに定容する。(⇒マトリックス合わせ検量線系列:0ppm, 1ppm,2ppm)
- 吸光度測定:TMBZ添加して90~120分後にPS製光学セル(10 mm)に試料液を入れて450.5 nmの吸光度を測定し、検量線からCe(Ⅳ)濃度を定量し、試料中濃度を算出する。検量線範囲より濃い場合は適宜標準液を作製して吸光度測定を行う。試料液にはHFが含まれるので、取り扱いに注意する。
4.8. ガラス試料の測定例
CeをCeO2として1.85 wt%添加されたソーダライム系ガラスに対して本法をN=2で適用した例をTable 8に示す。Ce(Ⅳ)濃度はN=2で良好な繰り返し再現性がみられる。

5. 結言
高感度な酸化発色剤を用いることでガラス中5 ppm μg/g)以上のCe(Ⅳ)を測定できる定量法を確立した。ガラス試料溶解に用いるHFによるCeフッ化物沈殿生成の影響は硫酸ジルコニウム添加で回避した。有機物などの還元性不純物は極微量でも定量の大きな誤差要因になるため、容器の洗浄に注意が必要である。Ce総量はJIS8)9)に準じて定量し、差からCe(Ⅲ)を算出することでCe価数別定量が可能である。
参考文献
- ガラスハンドブック 朝倉書店
- 同仁化学HP
- 高木誠二"定性分析化学(中巻)" 南江堂
- 化学便覧(五訂)
- 電気化学便覧
- 分析化学データブック(3版)
- 樽谷俊和;日本化学雑誌77[8](1956): 1292-1295
- JIS R 3101(ソーダライムガラスの分析法)
- JIS R 3105(ホウケイ酸ガラスの分析法)