AGC Research Report 75(2025)
フローマイクロリアクターを用いた集積型反応の開発
Development of Integrated Reactions Using Flow Microreactors
早乙女 広樹*・永木 愛一郎**
Hiroki Soutome, Aiichiro Nagaki
*AGC株式会社 材料融合研究所(hiroki.soutome@agc.com)
**北海道大学大学院理学研究院(nagaki@sci.hokudai.ac.jp)
フローマイクロリアクターによる有機合成は、微細な反応空間を活かし、バッチ型反応では困難な不安定活性種の利用と精密な反応制御を実現する。複数のフロー型反応器を接続することで、反応中間体の分離工程を省いて化学反応を連続的に行う集積型反応が注目されている。この集積型合成手法は、分離・精製などに伴うコストの削減に加え、単純な化合物から一挙に複雑化合物へと誘導できる点など、様々な利点がある。しかし、無機塩などの低溶解性化合物を生成する有機反応における流路の閉塞リスクや、低溶解性の基質を取り扱うことが難しいというフロー反応特有の課題があり、また、従来は主にアニオン性活性種が本領域での研究対象になっていたことから反応の多様性に限界があった。こうした背景から本稿では、(1)カルボカチオンの高速・不可逆的な発生法を確立し有機リチウム種と直接反応させる新反応系を構築、(2)有機溶媒に対する溶解度の低いピリジン塩酸塩類をモデル基質とし前処理と有機反応を集積化したフロー合成システムを開発した。これらの研究から、バッチ型反応では困難なC-C結合形成反応の実現と高付加価値化合物への効果的なアクセスに成功した。
Organic synthesis utilizing flow microreactors takes advantage of confined reaction spaces, enabling the use of unstable reactive species and offering precise reaction control that conventional batch reactors struggle to provide. Integrated reactions, achieved by interconnecting multiple flow reactors to eliminate the need for intermediate separation steps and facilitate continuous chemical processing, have attracted significant attention. This integrated synthesis approach presents numerous advantages, including reduced costs related to separation and purification, as well as the ability to construct complex molecular structures from basic materials in a single flow. However, flow reactions come with inherent challenges, including the risk of channel clogging when organic reactions generate low solubility compounds such as inorganic salts and difficulties in handling substrates with low solubility. Previous investigations in this area have primarily concentrated on anionic reactive species, limiting the diversity of reactions. In this context, this report details the following: (1) the establishment of a rapid and irreversible method for generating carbocations, resulting in a novel reaction system in which cationic species directly react with organolithium species; (2) the development of a flow synthesis system that integrates pretreatment and organic reactions using pyridinium hydrochloride salts with low solubility in organic solvents as a model substrate. These investigations have successfully facilitated C–C bond formation reactions that are challenging to execute in batch processes, providing effective access to high value-added compounds.
1. 緒言
現代社会において、人々は有機合成技術により得られる物質によって豊かな生活を享受している。近年、生活水準の向上に伴い高機能化の要求が高まった結果、物質の化学構造は複雑化してきている。こうした複雑な化合物の合成には多段階の合成スキームが要求されるが、これには多大な時間とコストがかかる。これまでに、ワンポット合成法などさまざまな手法が開発されてきた(1)が、複雑な化合物を効率的に合成するためには、各段階の化学反応を精密に制御することが不可欠である。
有機合成反応を精密に制御する手法の一つとして、フロー合成法が広く知られている(2)。特に高い反応制御性が求められる場合には、反応管径の小さいフローマイクロリアクターを用いることが有効であり、その微細な反応空間を活かした特異な反応制御が実現する(Fig. 1)(3)。つまり、狭い空間内で反応液が混合されるため混合時間が小さく、細い反応管を用いることで反応液の体積あたりの表面積が増大し、反応温度の制御性が向上する。また、反応管の体積と反応液の流速を選択することで、任意の滞留時間の後に次の反応剤を導入することが可能となる。これらの特徴を活かすことで、フラスコなどのバッチ型反応器では困難な、安定性の極めて低い活性種の活用や高い反応選択性の制御が可能になる(4)。永木らは、不安定なリチウムカルベノイド種をフローリアクター内で発生させ、直ちに続く反応へと利用することで、-60 ℃でわずか13ミリ秒という短い寿命の活性種を効率的に合成化学に適用できることを示した(Fig. 2)(5)。
また、フロー型反応器を複数接続することで、反応液を次々に導入しながら化学反応を連続的に進行させる反応集積化技術が知られている(6)。ここで、高反応性の活性種を用いた高速な化学反応を集積化することにより、複数の化学反応を短時間で進行させることが可能になる。反応性の高い有機リチウム種を用いたフロー合成反応を集積化し、1,3,5-トリブロモベンゼンを出発物質としてわずか13秒以内に6段階の反応を完結させ、医薬品前駆体を一挙に合成する手法が報告されている(Fig. 3)(7)。
この集積型合成手法には、分離・精製に伴うコスト削減に加え、単純な化合物から短時間で複雑な化合物へと誘導できるという利点がある。しかしながら、無機塩などの低溶解性化合物を生成する有機反応では流路の閉塞リスクや、低溶解性基質の取り扱いの困難さといったフロー反応特有の課題がある。さらに、従来は主にアニオン性活性種が研究対象となっていたため、反応の多様性に限界があった。こうした背景から我々は以下の研究に取り組んだ。つまり、(1)カルボカチオンの高速・不可逆的な発生法を確立し有機リチウム種と直接反応させる新反応系を構築、(2)有機溶媒に対する溶解度の低いピリジン塩酸塩類をモデル基質とし前処理と有機反応を集積化したフロー合成システムを開発した(Fig. 4)。
2. 実験結果と考察
2.1. フロー法によるカルボカチオンの新規発生法開発と有機リチウム種との直接反応(8)
フローマイクロリアクターを用いた精密な反応制御により、バッチ法では取り扱いが困難な高反応性活性種を利用して、数秒以内に完結する高速合成反応の研究が進められている。これまで、こうした反応で用いられる活性種はハロゲン-リチウム交換反応や還元的メタル化、脱プロトン化などにより生成されるアニオン性化学種が中心であった(9)。新たな様式の活性種が発生・利用可能となれば、高反応性活性種を用いた合成化学に新たな展開が期待される。そこで我々は、逆の極性を持つカチオン性のカルボカチオンを発生させ、その分解前に直ちに合成反応へ適用する手法の開発に取り組んだ。
カルボカチオンは、Lewis酸や化学酸化を用いる手法(10)や電気化学的手法(11)などで発生させることができるが、この活性種を高速かつ不可逆的に生成する手法は非常に限られている。永木らは2010年に、超強酸であるトリフルオロメタンスルホン酸を用いたビニルエーテル類の高速な重合反応を報告し、その中でカチオン性の重合性活性種を発生させ、活性化部位を利用した高分子末端の官能基化を達成した(12)。この反応を等量反応へと展開することができれば、目的とするカルボカチオンの発生法開発につながると考えた。
2.1.1. バッチ法によるカルボカチオンの発生法検討
環状エナミン1aをモデル基質として、カルボカチオンの発生条件を検討した(Fig. 5)。ここでは、この基質に対するトリフルオロメタンスルホン酸による活性化と、その後のアリルトリメチルシランへの求電子反応により得られる付加体3の収率を調査した。まず、バッチ法において試薬の添加順や反応温度を変化させながら合成を試みた結果、目的物の収率は低く、最大でも40 %台に留まった。
2.1.2. フロー法によるカルボカチオンの発生法検討
この反応では、基質と酸の混合効率がカチオン性活性種の発生に重要であると考え、フローマイクロリアクターを用いて合成を実施した。最適な合成条件を見出すため、カチオン種を発生させるリアクターの滞留時間と温度を変化させながら合成を行い、目的物の収率をプロットした結果をFig. 6に示す。その結果、この反応系では、滞留時間が0.021秒、反応温度が15 ℃の場合に最大収率78 %が得られることが明らかとなった。
さらに、全体の流速やM1で示す基質と酸を混合する部分のマイクロミキサーの形状が混合効率に影響を与えると考え、これらについて検討を行った。Fig. 7
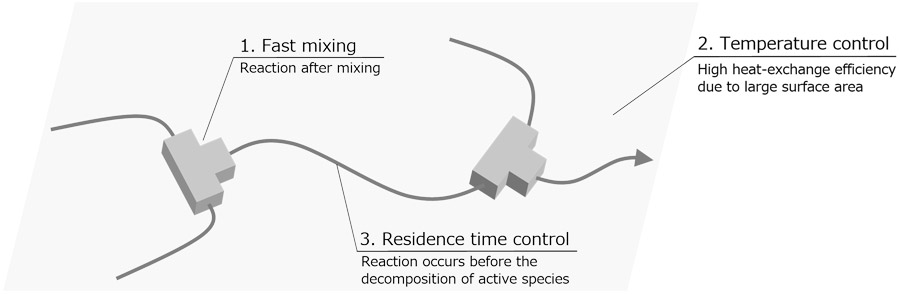 Fig. 1 Advantages of a Flow Microreactor.
Fig. 1 Advantages of a Flow Microreactor.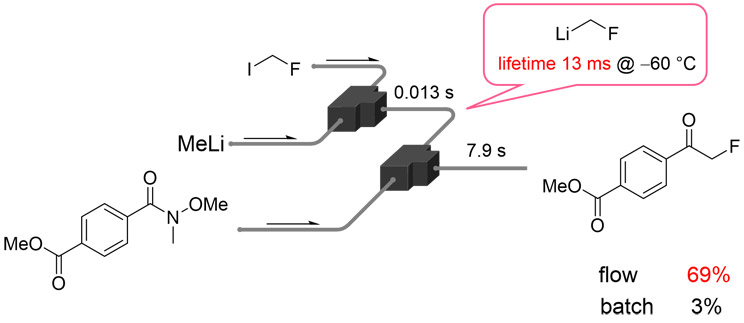 Fig. 2 Utilizing an Unstable Intermediate.
Fig. 2 Utilizing an Unstable Intermediate.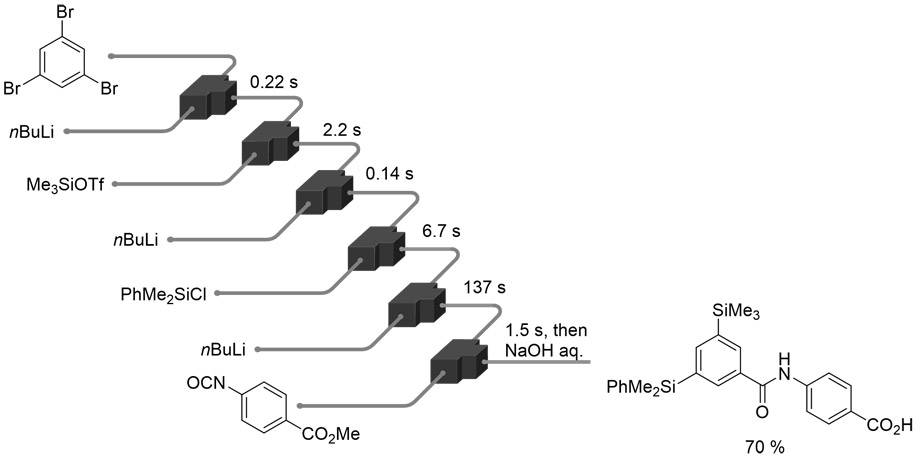 Fig. 3 Integrated Reaction to Synthesize a Drug Precursor.
Fig. 3 Integrated Reaction to Synthesize a Drug Precursor.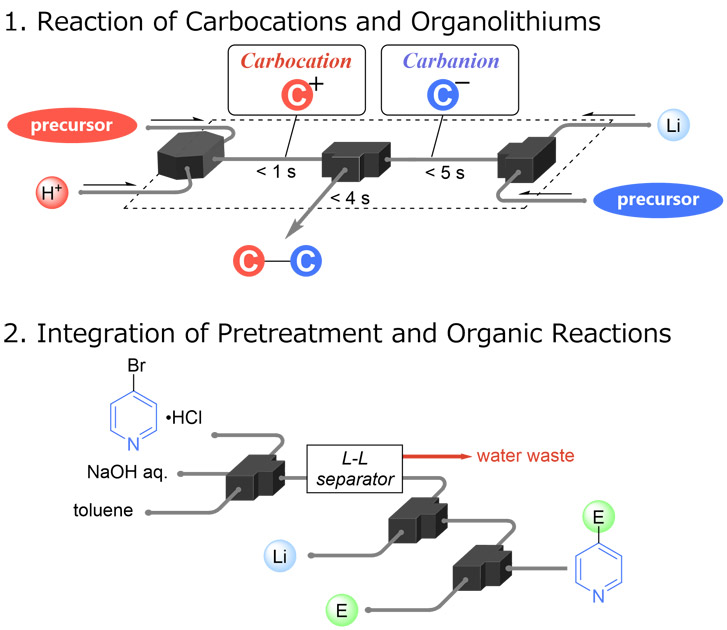 Fig. 4 Integrated Flow Systems Reported in This Article.
Fig. 4 Integrated Flow Systems Reported in This Article.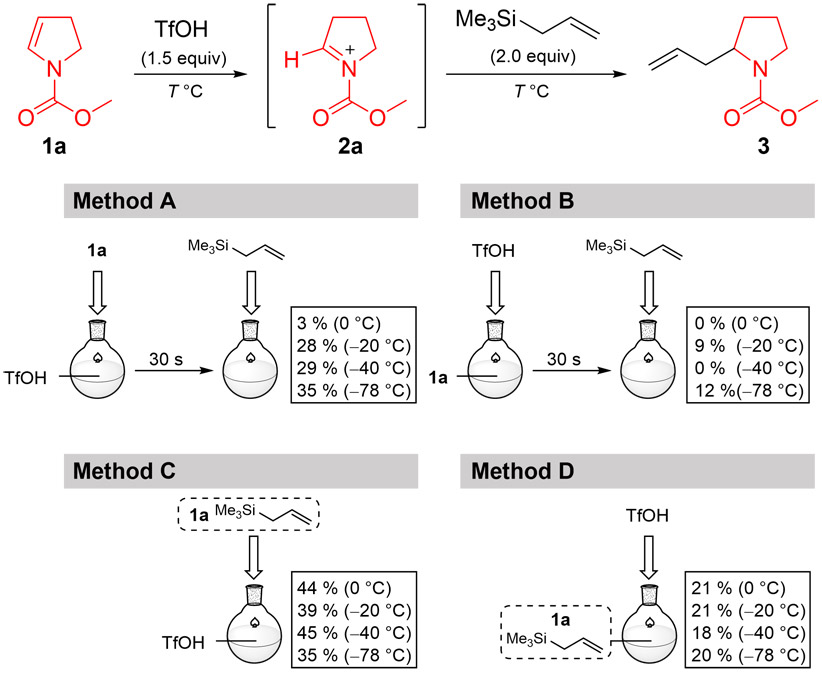 Fig. 5 Generation and Reaction of Carbocation in Batch.
Fig. 5 Generation and Reaction of Carbocation in Batch.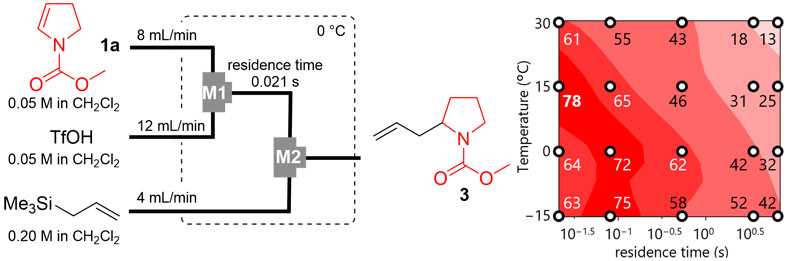 Fig. 6 Generation and Reaction of Carbocation in Flow.
Fig. 6 Generation and Reaction of Carbocation in Flow.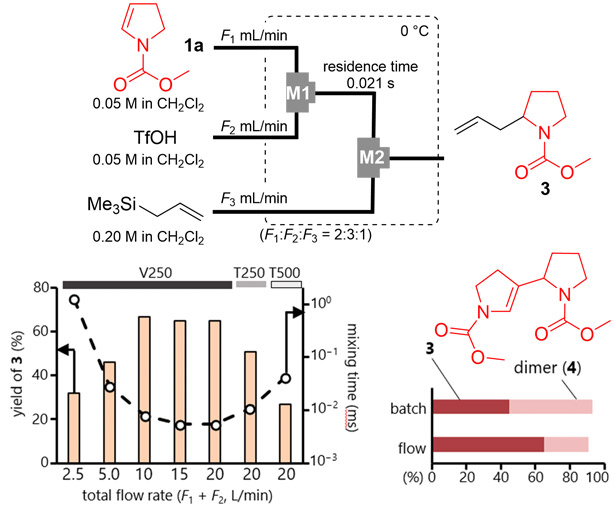 Fig. 7 Effects of Mixing Efficiency in Flow.
Fig. 7 Effects of Mixing Efficiency in Flow.に示す結果から、全体の流速が増加するにつれて混合時間が短縮され、それに伴い目的物の収率が向上する傾向が認められた。さらに、流速を一定に保ちながらミキサーの形状 を変更すると、混合時間が長くなるミキサーを使用したの場合、収率が低下することが明らかとなった。また、この反応における主な副生物はダイマー4であることが確認された。バッチ法とフロー法それぞれで最も高収率が得られた条件下で比較したところ、フロー法の方がダイマーの生成を抑えられるために目的物の収率が向上したと示唆された。これらの結果は、エナミン1aとトリフルオロメタンスルホン酸の混合効率を向上させることで、効率的な活性種の発生が可能になることを示唆している。
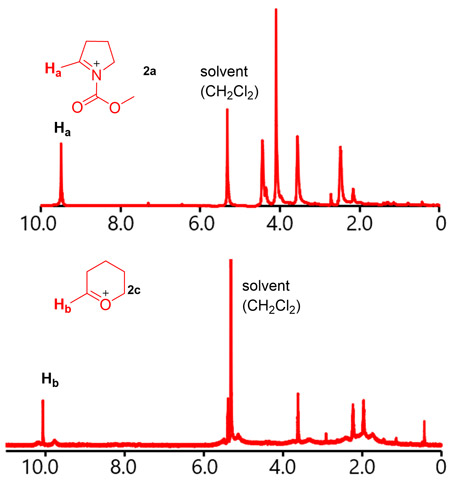 Fig. 8 Low Temperature NMR Analysis of Carbocations.
Fig. 8 Low Temperature NMR Analysis of Carbocations.2.1.3. フロー法によるカルボカチオンの発生法検討
トリフルオロメタンスルホン酸による活性化で生成する活性種について知見を得るため、フロー法を用いてエナミンを活性化した反応混合物の低温NMR測定を-78 ℃で実施した。Fig. 8に示すように、6.5 ppm付近に特徴的なピークを有する原料のシグナルは完全に消失し、9.5 ppm付近に特徴的なピークを有するカルボカチオン2aが不可逆的に生成していることが確認された。さらに、類似する構造をもつ環状エノールエーテルを用いて同様の測定を行ったところ、オリゴマー副生物由来と思われるピークを伴いながらカルボカチオン2bの生成が確認された。これらの結果から、フロー法により高速かつ不可逆的にカルボカチオンを発生させる手法が開発された。
2.1.4. 反応集積化を利用したカルボカチオンと有機リチウム種の直接反応
カルボカチオンおよびカルバニオンは、いずれも有機合成化学における重要な化学種であるが、その安定性が低いため、これらを直接反応させた場合の結果については、これまでに知る限り報告がなかった。カチオンとアニオンが直接反応してC-C結合を形成する可能性を考慮し、上記のカチオン発生法を応用して反応の検討を行った。
カチオン性活性種の原料としてエナミン1aを用い、アニオン性活性種としてはアルキル金属化学種(n -C4H9-M+)を使用して合成反応を実施した(Fig.9)。M=Li(ノルマルブチルリチウム)の場合、目的の反応が優先的に進行し、化合物5が収率72 %で得られた。また、カウンターカチオンとして異なる金属種を用いた場合、M=MgClでは収率65 %、M=ZnClでは33 %となり、結合のイオン性が低下するほど収率が低下する傾向が見られた。以上の結果から、カチオンとアニオンを直接反応させることで、C-C結合形成反応が進行することが示された。
2.1.5. アニオン性活性種の基質適用範囲の検討
さらに、フローマイクロリアクターを用いた数秒以内の高速活性化により有機リチウム種を発生させる手法が複数報告されている。これらの手法を応用し、短寿命な活性種同士によるカチオンとアニオンの直接反応の基質適用範囲を検討した。その結果、ハロゲン-リチウム交換反応を利用して発生させたアリールリチウム種や、脱プロトン化反応により発生するアルキニルリチウム種を含む、様々な活性種との反応が良好な収率で進行することが示された(Fig. 10(a))。特に、リチウム種に対して不安定な官能基を有する活性種(12, 17, 18, 19)を用いた場合でも、フロー法による全体で数秒以内という高速反応条件を適用することで、保護基を使用せずに合成利用が可能であった。
2.1.6. カチオン性活性種の基質適用範囲の検討
また、カチオン側活性種の構造の多様性についても検討した(Fig. 10 (b))。ピロリジンのアミン上の保護基として、酸に不安定なBoc保護基を用いた場合(20, 21)や二重結合を有するAlloc保護基を用いた場合(22, 23)でも、高い収率で目的物が得られた。さらに、カチオン側原料として、5員環のピロリジン骨格から6員環のピペリジン骨格に変更した場合(24,25)、酸素を含む環(26)、および非環状性のチオニウムイオンを用いた場合(27)においても、同様の反応が進行した。
2.1.7. 非対称アルキンの合成
本研究で開発したカチオンとアニオンの直接反応を応用し、通常は多段階反応が要求される非対称アルキンの合成を試みた(Fig. 11)。まず、アニオン側原料としてトリメチルシリルアセチレンを用いて反応を行い、その後脱保護を施すことで、収率85 %で末端アルキンを有する化合物が得られた。この生成物をアニオン側原料として反応させることで、非対称アルキンを高速かつ簡便な手順で合成できることが示された。
2.2. ピリジン塩酸塩類に対する反応の前処理と禁水反応のフロー集積化(13)
フロー合成反応を行う際には、有機溶媒中に基質を十分に溶解させる必要がある。この連続型反応系では、流路内の一部が閉塞するだけで全体の反応が停止してしまうため、一般に反応液中に固体が存在しないこと、また反応中に固体が析出しないよう制御することが求められる。しかし、有機合成において有用な原料の中には、有機溶媒への溶解度が低く前処理が必要なものも存在する。
その一例がピリジン塩酸塩類である。ピリジン誘導体は、機能性分子のビルディングブロックとして知られている重要な化合物群だが、ピリジンの求核性により、置換基によっては高濃度条件下で自己重合を起こす例が報告されている(14)。そのため、これらの化合物は塩酸塩として安定化され市販されているが、一般的に有機溶媒への溶解度は低い。そのため、有機合成反応に用いるには、塩基性水溶液による脱塩操作で脱塩体を取り出す必要がある。しかしながら、この脱塩体は安定性が低いため、操作手順によっては反応の効率が低下する恐れがある。そこで、不安定な中間体を取り出すことなく、反応の前処理から有機反応までを一括で処理できるワンフロー反応系の開発に取り組んだ。
2.2.1. 4-ブロモピリジン塩酸塩の脱塩処理の検討
ここでは、臭素置換基を反応の起点として利用できる可能性が高い4-ブロモピリジン塩酸塩をモデル基質として検討を行った。まず、バッチ法により水酸化ナトリウム水溶液を用いて脱塩処理を実施し、その後、有機溶媒による抽出を行った。その結果、抽出溶媒としてトルエンを用いた場合、分液操作後の有機層中の水分量が281 ppmと低く抑えられることが確認された。連続処理が可能なフロー反応系の利点を活かすため乾燥操作を省略できる可能性があるトルエンを抽出溶媒として選択した。
2.2.2. 脱塩体のリチオ化と続く求電子剤との検討
先ほどの操作で得られた脱塩体を用いて、有機反応の検討を進めた。ここでは、水に敏感な禁水反応を選択し、本手法の有用性を検証した。まず、バッチ法によりTHFで希釈した有機層に対して、ノルマルブチルリチウムを用いたリチオ化および続くヨードメタンによるメチル化反応を行ったが、いずれの温度条件においても低収率に留まった(Fig. 12 (a))。これは、置換位置の異なるブロモピリジン誘導体でも示されているように、活性化されたピリジンの安定性が低いことが原因だと考え、フロー法を適用した。リチオ化の活性化時間と温度を検討した結果、目的のメチル化体は滞留時間0.22秒、反応温度-20 ℃の場合に最大収率70 %を示すことが明らかとなった(Fig. 12 (b))。また、異なる求電子剤を用いた場合も中程度の収率で目的物が得られることが分かった。
2.2.3. ワンフロー反応系の構築
これまでに検討した脱塩処理ならびに有機反応をを連続的に処理することを試みた。有機層と水層をフロー系内で分離することを目的として、Zaiput社の液-液セパレーター「SEP-10」をフロー装置に組み込んだ。脱塩・抽出操作のフロー検討では、基質と水酸化ナトリウム水溶液さらに抽出溶媒としてトルエンを一つのマイクロミキサーで混合し、4.4秒後にSEP-10を用いて水分離を行ったところ、分離後の有機層の水分量がバッチ法と同様に低く保たれることが確認された。さらに、この抽出されたフロー系内の有機層をTHFで希釈し、リチオ化およびボリル化試薬の添加を行った。その結果、脱塩・抽出・反応までを一括で処理するこのワンフロー反応系は約20秒で一連の処理を完了させ、目的のボリル化生成物40が収率78 %で得られた(Fig. 13)。この収率は、抽出のみをバッチ法で処理した。この収率は、抽出のみをバッチ法で
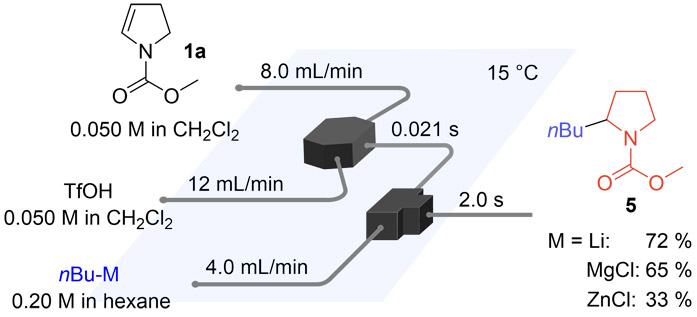 Fig. 9 Reaction of Carbocation and nBu-M.
Fig. 9 Reaction of Carbocation and nBu-M.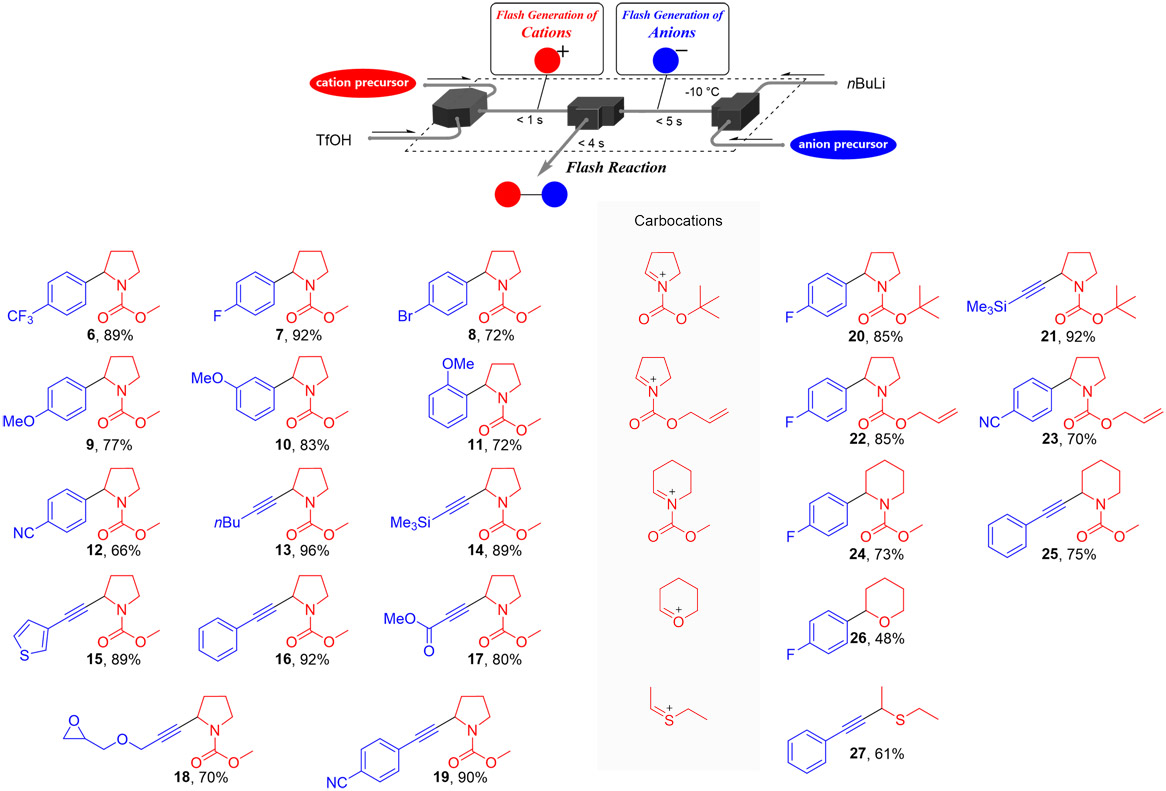 Fig. 10(a) Substrate Scope of Anionic Intermediates.(b) Substrate Scope of Cationic Intermediates.
Fig. 10(a) Substrate Scope of Anionic Intermediates.(b) Substrate Scope of Cationic Intermediates.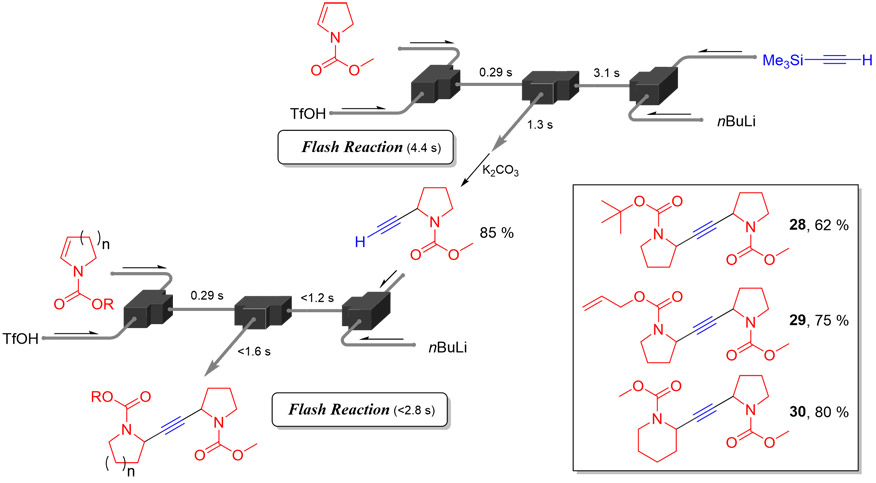 Fig. 11 Easy Access to Unsymmetric Alkynes.
Fig. 11 Easy Access to Unsymmetric Alkynes.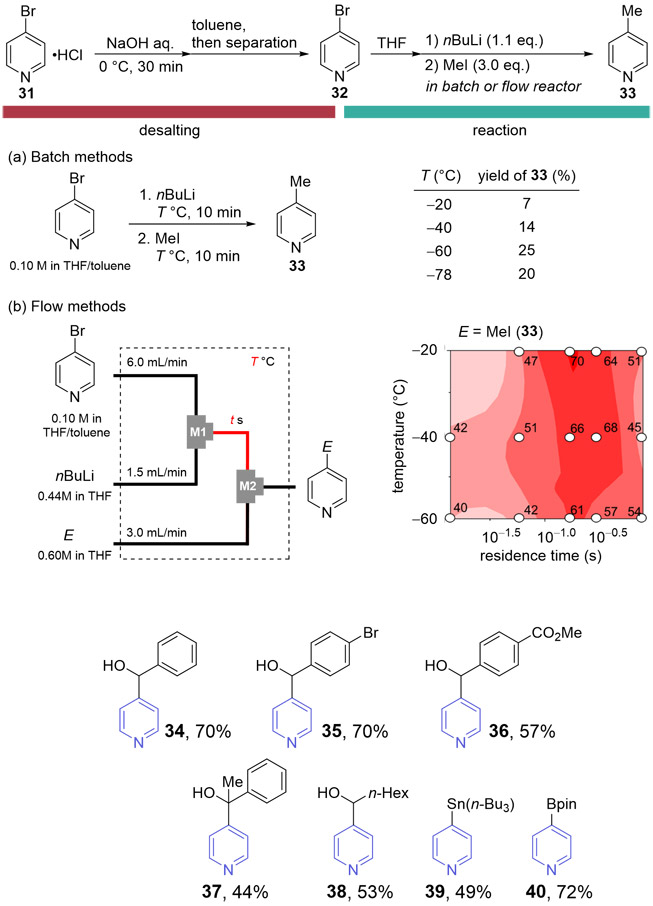 Fig. 12 Desalting and Reaction of 4-bromopyridine hydrochloride.
Fig. 12 Desalting and Reaction of 4-bromopyridine hydrochloride.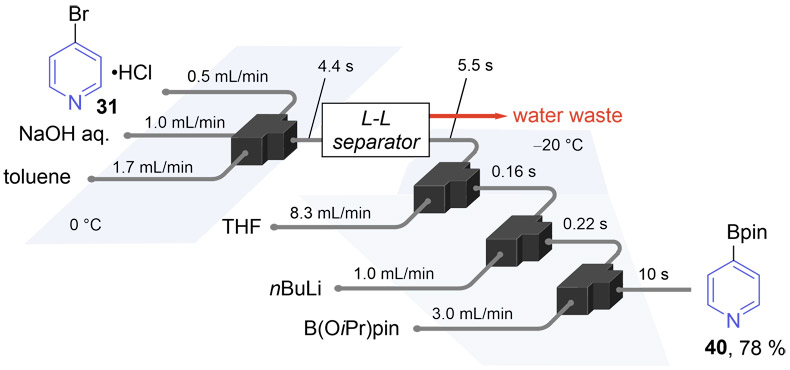 Fig. 13 One-Flow Synthetic System Using a L-L Separator.
Fig. 13 One-Flow Synthetic System Using a L-L Separator.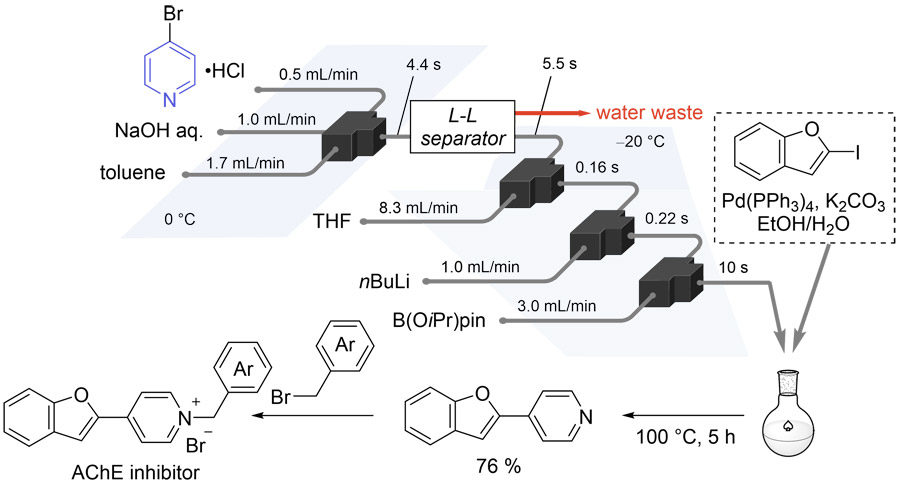 Fig. 14 Integration of One-Flow Synthesis and SMC reaction.
Fig. 14 Integration of One-Flow Synthesis and SMC reaction.処理した場合の72 %よりもわずかに高く、ワンフロー反応の導入により反応の処理時間が短縮されるとともに、不安定な中間体を取り出さないことによる収率向上の効果も示唆された。
2.2.4. 鈴木-宮浦クロスカップリング(SMC)反応への接続
このようにして得られたボリル化されたピリジンは、カップリング反応を通じて機能性分子へ展開することが可能である。先に構築したワンフロー反応系で得られた反応混合物に対して、クエンチ等の処理を行うことなくカップリング反応の試薬を添加したところ、AChE阻害活性物質(15)の前駆体が良好な収率で得られることが確認された(Fig. 14)。
3. 実験方法
3.1. カルボカチオンと有機リチウム種の直接反応2-(4-トリフルオロメチルフェニル)ピロリジン-1-カルボキシレート(6)
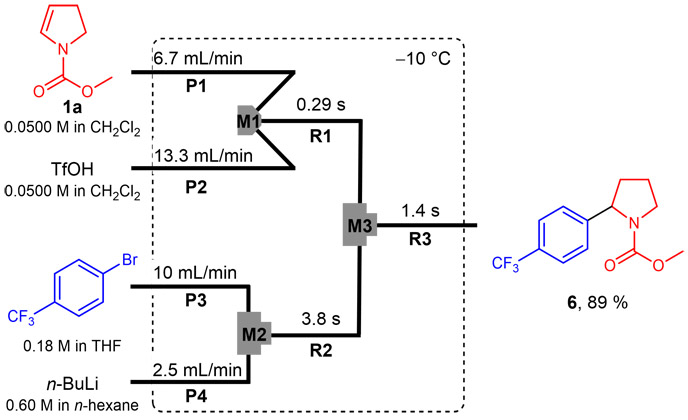
V字型マイクロミキサー(M1、φ =250 μm)、T字型マイクロミキサー2つ(M2とM3、φ =250 μm)、マイクロチューブリアクター3つ(R1–R3)、および4つの予冷ユニット(P1–P4)からなるフローマイクロリアクターシステムを用いた。フローマイクロリアクターは-10 ℃の冷却浴に浸した。カチオン前駆体(1-メチルピロリジン-2-カルボン酸メチル(1a)、CH2Cl2中0.0500 M、流速:6.7 mL/min)の溶液とトリフルオロメタンスルホン酸(CH2Cl2中0.0500 M、流速:13.3 mL/min)の溶液は、シリンジポンプを用いてM1に導入され、その混合溶液はR1(L R1= 12.5cm、t R1= 0.29 s)を通過して、M3に到達した。一方、4-ブロモベンゾトリフルオリド(THF中0.180 M、流速:10 mL/min)の溶液とノルマルブチルリチウム(ノルマルヘキサン中0.60 M、流量:2.5 mL/min)の溶液はシリンジポンプを用いてM2に導入され、混合溶液はR2(L R2= 100 cm、t R2= 3.8 s)を通過して、M3に到達した。これらの溶液はM3で混合され、反応溶液はR3(L R3= 100 cm、t R3= 1.4 s)を通過した。定常状態に達した後、反応混合物の一部を回収し、飽和塩化ナトリウム水溶液で処理した。この反応混合物について内部標準物質を用いてガスクロマトグラフィーにより分析したところ、目的のメチル2-(4-トリフルオロメチルフェニル)ピロリジン-1-カルボキシレート(6)が収率89 %で得られたことが確認された。
3.2. 脱塩と有機反応のワンフロー反応4-(4,4,5,5-テトラメチ ル-1,3,2-ジオキサボラン-2-イル)ピリジン(40)
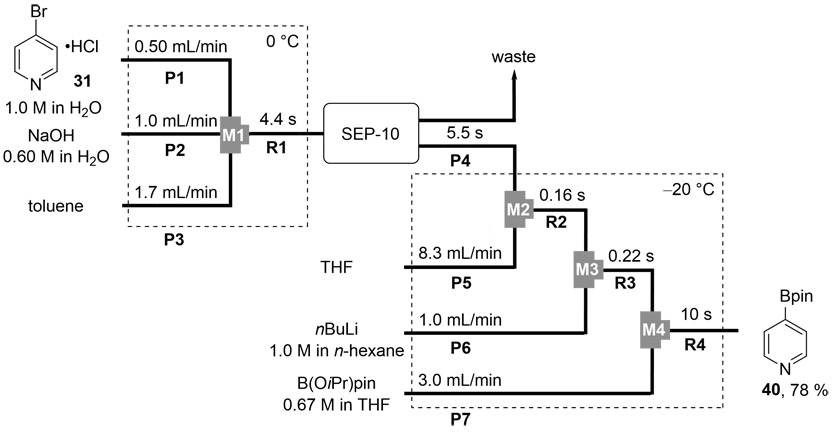
三方マイクロミキサー(M1、φ =500 μm)、T字型マイクロミキサー3つ(M2–M4、φ =500 μm)、マイクロチューブリアクター4つ(R1–R4)、および7つの予冷ユニット(P1–P7)、Zaiput社製のSEP-10フロー液液分離装置(疎水性PTFE分離膜OB-900を使用)からなるフローマイクロリアクターシステムを用いた。SEP-10より前のフローマイクロリアクターは0℃の冷却浴に浸し、後のフローマイクロリアクターは-20 ℃の冷却浴に浸した。4-ブロモピリジン塩酸塩の水溶液(1.0 M、流速:0.50 mL/min)と、水酸化ナトリウム水溶液(0.60 M、流速:1.0 mL/min)と、トルエン(流速:1.7 mL/min)は、シリンジポンプを用いてM1に導入され、その混合溶液はR1(L R1= 30cm、t R1= 4.4 s)を通過して、SEP-10に到達した。SEP-10により水層と有機層が分離され、有機層はP4を通過した後にTHF(流速:8.3 mL/min)とミキサーM2で混合された。混合溶液はR2(L R2= 3.5 cm、t R2= 0.16 s)を通過して、M3でノルマルブチルリチウム(ノルマルヘキサン中1.0 M、流速:1.0 mL/min)の溶液と混合された。混合溶液はR3(L R3= 3.5 cm、t R3= 0.22 s)を通過して、M4でイソプロポキシボロン酸ピナコールエステル(THF中0.67 M、流速:3.0mL/min)の溶液と混合され、反応溶液はR4(L R4=100 cm、t R4= 10 s)を通過した。定常状態に達した後、反応混合物の一部を回収し、飽和塩化アンモニウム水溶液で処理した。この反応混合物について内部標準物質を用いてガスクロマトグラフィーにより分析したところ、目的の4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボラン-2-イル)ピリジン(40)が収率78 %で得られたことが確認された。
4. 総括
本研究では、フローマイクロリアクターを用いた集積型合成系により、カルボカチオンの高速・不可逆的な発生法を確立し、その分解前に有機リチウム種と直接反応させる新たな反応系を構築した(8)。この手法により、フロー系中で発生させた種々のカチオン性、およびアニオン性活性種を用いたC-C結合形成反応を高収率で実現し、高付加価値化合物への効率的なアクセスが可能となった。さらに、フロー系に接続できる液-液分離膜を用いることで、分液操作と禁水反応を集積化したフロー合成系を開発した(13)。このワンフロー反応により、前処理から有機反応までを一括で処理することで、反応の処理時間短縮と不安定活性種の即時利用による収率の向上が確認された。本研究の成果は、フロー合成技術の新たな可能性を示すとともに、集積型反応の有用性を拡張するものである。今後の展開として、さらに多様な反応系への応用や、大スケールでの実装に向けた研究(16)が期待される。
5. 謝辞
本研究は、私が北海道大学の社会人博士課程在籍時に行ったもの(17)であり、研究室への受け入れおよびご指導を賜りました永木愛一郎教授ならびに永木研究室の皆様に、心より感謝申し上げます。
参考文献
- (a)Wender, Paul A. “Toward the ideal synthesis and transformative therapies: the roles of step economy and function oriented synthesis.” Tetrahedron 69.36(2013): 7529.(b)Hayashi, Yujiro. “Pot economy and one-pot synthesis.” Chemical science 7.2(2016): 866-880.(c) Plutschack, Matthew B., et al. “The hitchhiker’s guide to flow chemistry.” Chemical reviews 117.18(2017): 11796-11893.(d)Hessel, Volker, et al. “Sustainability of flow chemistry and microreaction technology.” Green Chemistry(2024)
- Cambie, Dario, et al. “Applications of continuous-flow photochemistry in organic synthesis, material science, and water treatment.” Chemical reviews 116.17(2016): 10276-10341.
- Hartman, Ryan L., Jonathan P. McMullen, and Klavs F. Jensen. “Deciding whether to go with the flow: evaluating the merits of flow reactors for synthesis.” Angewandte Chemie International Edition 50.33(2011): 7502-7519.
- (a)Petersen, Trine P., Matthias R. Becker, and Paul Knochel. “Continuous flow magnesiation of functionalized heterocycles and acrylates with TMPMgCl・LiCl.” Angewandte Chemie International Edition 53.30(2014): 7933-7937.(b)Yoshida, Jun-ichi, Yusuke Takahashi, and Aiichiro Nagaki. “Flash chemistry: flow chemistry that cannot be done in batch.” Chemical communications 49.85(2013): 9896-9904.(c)Nagaki, Aiichiro, et al. “Flash chemistry makes impossible organolithium chemistry possible.” Chemistry Letters 50.3(2021): 485-492.(d) Shamoto, Otoka, et al. “Peptide cyclization by the use of a c y l a m m o n i u m s p e c i e s . ” A n g e w a n d t e C h e m i e International Edition 62.27(2023): e202300647.
- Colella, Marco, et al. “Fluoro ‐ substituted methyllithium chemistry: external quenching method using flow microreactors.” Angewandte Chemie 132.27(2020): 11016-11020.
- Britton, Joshua, and Colin L. Raston. “Multi-step continuous-flow synthesis.” Chemical Society Reviews 46.5(2017): 1250-1271.
- Nagaki, Aiichiro, et al. “Flash synthesis of TAC-101 and its analogues from 1, 3, 5-tribromobenzene using integrated flow microreactor systems.” RSC Advances 1.5(2011): 758-760.
- Soutome, Hiroki, et al. “Convergent approach for direct cross-coupling enabled by flash irreversible generation of cationic and anionic species.” Nature Communications 15.1(2024): 4873.
- (a)Ashikari, Yosuke, et al. “A synthetic approach to dimetalated arenes using flow microreactors and the switchable application to chemoselective cross-coupling r e a c t i o n s . ” J o u r n a l o f t h e A m e r i c a n C h e m i c a l Society 142.40(2020): 17039-17047.(b)Jiang, Yiyuan, Takashi Kurogi, and Hideki Yorimitsu. “Reductive stereoand regiocontrolled boryllithiation and borylsodiation of arylacetylenes using flow microreactors.” Nature Synthesis 3.2(2024): 192-201.(c)Lee, Hyune-Jea, et al. “Ex-situ generation and synthetic utilization of bare trifluoromethyl anion in flow via rapid biphasic mixing.” Nature communications 14.1(2023): 1231.(d)Song, Zhen-Lei, Chun-An Fan, and Yong-Qiang Tu. “Semipinacol rearrangement in natural product synthesis.” Chemical reviews 111.11(2011): 7523-7556.
- Tu, Wangyang, and Paul E. Floreancig. “Oxidative carbocation formation in macrocycles: Synthesis of the n e o p e l t o l i d e m a c r o c y c l e .” A n g e w a n d t e C h e m i e International Edition 48.25(2009): 4567-4571.
- (a)Yoshida, Jun ‐ ichi, and Seiji Suga. “Basic concepts of “cation pool” and “cation flow” methods and their applications in conventional and combinatorial organic synthesis.” Chemistry –A European Journal 8.12(2002): 2650-2658.(b)Yan, Ming, Yu Kawamata, and Phil S. Baran. “Synthetic organic electrochemical methods since 2 0 0 0 : o n t h e v e r g e o f a r e n a i s s a n c e . ” C h e m i c a l Reviews 117.21(2017): 13230-13319.(c)Wiebe, Anton, et al. “Electrifying organic synthesis.” Angewandte Chemie International Edition 57.20(2018): 5594-5619.
- Iwasaki, Takeshi, Aiichiro Nagaki, and Jun-ichi Yoshida. “Microsystem controlled cationic polymerization of vinyl e t h e r s i n i t i a t e d b y C F 3 S O 3 H . ” C h e m i c a l Communications 12(2007): 1263-1265.
- Soutome, Hiroki, et al. “One-Flow Operation via 4-Bromopyridine Enables Flash Synthesis of AChE Inhibitor.” Synthesis 56.05(2024): 821-827.
- Wibaut, J. P., and F. W. Broekman. “The polymerisation of 4 ‐ chloropyridine.” Recueil des Travaux Chimiques des Pays ‐Bas 78.8(1959): 593-603.
- B a h a r l o o , F a r z a n e h , e t a l . “ B e n z o f u r a n - d e r i v e d benzylpyridinium bromides as potent acetylcholinesterase inhibitors.” European journal of medicinal chemistry 93(2015): 196-201.
- Soutome, Hiroki, et al. “Highly Productive Flow Synthesis for Lithiation, Borylation, and/or Suzuki Coupling Reaction.” Organic Process Research & Development 28.5(2024): 2006-2012.
- Soutome, Hiroki. Convergent Approach of Carbocations and Organolithiums Using Integrated Flow System . PhD thesis, Hokkaido University, Sapporo, Japan, 2025.