AGC Research Report 72(2022)
Investigation of the state of Fe2+ ions doped in Na2O-RO-SiO2 glass( R= Mg, Ca)
Na2O-RO-SiO2ガラス(R= Mg, Ca)中のFe2+イオンの構造
土屋博之*
Hiroyuki Hijiya
*AGC株式会社 材料融合研究所( hiroyuki.hijiya@agc.com)
一般的に、工業原料には不純物としての鉄が含まれるため、鉄を含まない工業用ガラスはほとんど製造されていないと言ってよい。ソーダライムガラスに含まれる鉄は、紫外線から赤外線までの広い波長範囲の光を吸収するが、鉄イオンによる光吸収と配位および周囲のイオンの構造との関係についての報告は少ない。
本研究では、アルカリ土類イオンを含むソーダケイ酸塩ガラス中の鉄イオン周囲の構造を詳細に解析する。Na2O-RO-SiO2ガラスのROをCaOまたはMgOとしたガラスにFeをドープし、Fe2+に焦点を当てるために、ガラスは還元雰囲気下で作製した。Fe2+の周囲の構造は、分子動力学シミュレーション、X線吸収分光法によって調査した。その結果、アルカリ土類をCaOとした場合、Fe-O間距離が増大するとともにFe2+の6配位の構造が歪むことが示唆された。
Due to iron impurities in the raw materials, it is typically difficult to produce industrial glass without iron. From ultraviolet to infrared light, iron in soda-lime glass absorbs light over a broad wavelength range. However, reports on the relationship between the optical absorption and structure of the surrounding ions are few.
Herein, the structure of the surrounding ions of iron in simplified soda silicate glass with MgO or CaO is examined in detail. The glasses composed of Na2O, SiO2, and alkaline earth oxides(MgO or CaO)doped with FeO were strongly reduced to focus on the investigation of Fe2+. The surrounding structure of Fe2+ was examined using light, X-ray absorption spectroscopy, and molecular dynamics simulation. The results suggest that Fe2+ ions in Na2O-CaO-SiO2 glass show the longer Fe-O bond length and the higher degree of distortion of FeO6 octahedra as compared with those in Na2O-MgO-SiO2 glass.
1. 緒言
ソーダライムガラス(工業的にはNa2O-CaO-SiO2系をベースとしたガラスの総称であり、Al2O3やMgOなどの成分も含んでいる。)は、高い耐候性を有し、光透過性が良好であり、量産性に優れていることから開口部材としての建築用途、自動車用途、太陽電池用途として幅広く用いられている。大量生産する場合は高純度な試薬ではなく工業原料を使用するため、必ず鉄が不純物としてガラス中に混入し吸収(着色)を与えてしまう。このため、例えば太陽電池のカバーガラスとして用いる場合は、太陽電池に到達する光量が減少する観点から好ましくない。一方で自動車や建築用途の熱マネージメントの観点からは、積極的に鉄を添加し赤外域の吸収を高めることもある。
ソーダライムガラス中では、鉄はFe3+とFe2+の2つの価数を取ることが昔から知られている。Fe3+はd-d遷移による400nm付近に吸収があり、ガラスに黄色味を与える。Fe2+は同様にd-d遷移による1100nmを中心とした700nmから2500nmにブロードな吸収が現れ、可視にまで広がった吸収の裾野が薄い青色の原因となる。通常はこれらがある比率で混在するためにソーダライムガラスは緑色をしていることが多い。
ガラス中の鉄イオンの吸収係数および吸収波長の変化をもたらす要因についてTable 1にまとめた。吸収に影響がある要因について6種類に分類することができる。ガラス中の鉄量や鉄イオンのクラスタリングによる着色の変化については、長嶋らが報告を行っている(1)。また、母ガラスの塩基度でスペクトルが変化することも知られている(2)。これは配位数や配位子場が変化したものと考えられる。さらにソーダライムガラス中のFeイオン周辺の局所構造の組成による定性的な変化は、X線吸収微細構造(X-ray absorption fine structure : XAFS)(3)-(6)、電子スピン共鳴(Electron Paramagnetic Resonance : ESR)(7)を用いた測定により報告されている。ガラス中の鉄イオン(Fe2+)周辺の変化については、筆者(8)がMössbauer分光法を用いて議論を行っており、Galoisyらによって鉄イオンの酸素配位数の報告もなされている(9)。
本稿では、Na2O-RO-SiO2(ただし、ROはアルカリ土類金属酸化物を示す)ガラスでアルカリ土類金属の違いが、鉄イオン(Fe2+)周囲の構造に与える影響を調べた。鉄イオン周囲の構造を調べるためにXAFSでの鉄の吸収端の測定を行うとともに、XAFSから計算される動径分布と分子動力学法(m o l e c u l a r dynamics : MD法)を用いて作製したガラス中の鉄イオンの動径分布を比較することで、配位環境の変化について考察した。

2. 方法
2.1. 実験方法
Na2CO3、CaCO3、MgO、SiO2、Fe2O3を用いて母ガラスを16Na2O-10RO-74SiO2(mol%)(R=Mg, Ca)として外割で0.185Fe2O3(mol%)を添加して調合を行った。カーボン坩堝を用いて窒素雰囲気下の電気炉で1500 ℃、60分間溶融し、急冷することでガラスを得た。以下では、R=MgのガラスをガラスM,R=Ca
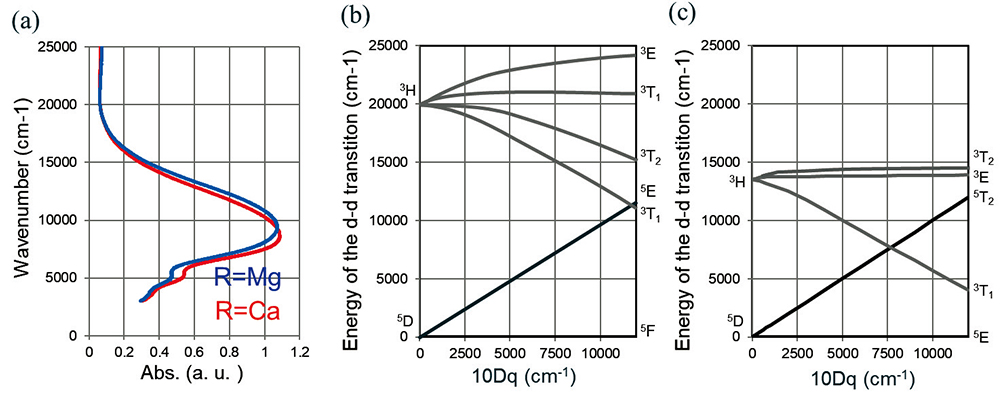 Fig.col-w100 1 Comparison of the absorption spectrum of Fe2+ in Na2O-RO-SiO2 glass with the Tanabe-Sugano diagrams.(a)Absorption spectrum of Fe2+ in Na2O-RO-SiO2 glass(R =MgO, CaO). The horizontal axis is the value standardized at the peak top.(b) Tanabe-Sugano diagram d6(oct)spreadsheet(B = 1000 cm-1)(c)Tanabe-Sugano diagram d6(tetra)spreadsheet(B = 1000 cm-1)
Fig.col-w100 1 Comparison of the absorption spectrum of Fe2+ in Na2O-RO-SiO2 glass with the Tanabe-Sugano diagrams.(a)Absorption spectrum of Fe2+ in Na2O-RO-SiO2 glass(R =MgO, CaO). The horizontal axis is the value standardized at the peak top.(b) Tanabe-Sugano diagram d6(oct)spreadsheet(B = 1000 cm-1)(c)Tanabe-Sugano diagram d6(tetra)spreadsheet(B = 1000 cm-1)のガラスをガラスCと表記する。ガラス中でのFeの価数については、ソーダライムおよびホウケイ酸ガラスの化学分析のための標準試験方法(ASTM C169-16)に従って測定を行いFe2+が100%であることを確認した。紫外可視赤外(UV-Vis.-IR)の分光測定はUV- Vis.-IR分光光度計(パーキンエルマー:ラムダ950)を用いて測定を行った。XAFSの測定については、 SPring-8のBL08B2を用いてFeのK端でEXAFSの測定を行った。
2.2. 計算方法
XAFSから求めたFeの動径分布とMD計算による動径分布を比較するためにDuのポテンシャルを用いて MD計算を行った。総粒子数は20000原子、内Fe2+イオンは14原子とした。
各ガラスモデルの作製は、まず、20000個の原子から成るランダム構造を3500 Kまで昇温し、3500 Kで500 ps間、初期構造の影響がなくなるよう溶解した。次に、 1 K/psの冷却速度で、300 Kまで線形に温度を下げたのち、300 Kで100 ps間構造を緩和させた。構造解析には、最後の100 ps間のデータを用いた。すべての MD計算は、温度・圧力が一定となるように、能勢の方法(10),(11)を用いて制御した。なお、圧力は0.1 MPa一定とした。MD計算にはLAMMPS(12)を用い、1 fsの時間刻みで時間積分を実行した。原子間相互作用にはBuckingham型のTeter Potential(13)を採用した。
3. 実験結果と考察
3.1. UV-Vis.-IR分光測定
Fig. 1(a)に各組成の吸収スペクトルを示す。縦軸にエネルギー(波数)、横軸に規格化した吸収係数を示した。Fe2+が周囲に酸素を6個配位し、これらが正八面体構造をなしているとすると、田辺菅野ダイヤグラムから、一光子励起可能なd-d遷移のエネルギーは Fig. 1(b)で表される。ここで、横軸はOの作る配位子場の強さを表している。図を簡便にするために記載は5重項と3重項の表記のみとし1重項を省略した。これは基底状態が5重項であり1重項への遷移確率が低いためである。また、同様にFe2+が周囲に酸素を4個配位し、これらが正四面体構造をなしているとすると、田辺菅野ダイヤグラムはFig. 1(c)で表される。
Fig. 1(a)では各組成で9000~10000 cm-1をピーク トップとするブロードな吸収が確認できる。このピークはアルカリ土類金属の種類をMgからCaに変えることで高エネルギーから低エネルギーにピークシフトとしている。また、5000 cm-1付近に小さい鋭いピークが確認できた。ソーダライムガラス中のFe2+は6配位が100%であることが報告(14)されているが、Fig.1(b)の配位子場を10000cm-1と考えると5000cm-1付近には準位がなく、6配位のFeのd-d遷移によるこのような低エネルギーピークが存在するとは考えにくい。一方で、Volotinenら(15)はNa2O-CaO-SiO2ガラス中でのFe2+の遷移準位の帰属として、10000 cm-1付近を 6配位の5F→5E、5000 cm-1付近を4配位の5E→5T2とし、スペクトルはそれらの重ね合わせであると報告している。また、Vercamerら(6) らはFe2+の四面体構造を持つStauroliteの光吸収について第一原理計算を行い、その遷移準位を5E→5T2であると報告している。したがって、Fe2+の赤外の吸収は6配位の5F→5Eの遷移(10000 cm-1)と4配位の5E→5T2の遷移(5000 cm-1)の重ね合わせであると考えることは妥当である。Fig. 1(a)において、ガラスCの6配位Fe2+の5F→5Eの遷移エネルギーが、ガラスM中のそれに比べて小さくなるのは、Fe-Oの結合距離が長くなり(次節参照)、配位子場強度が低下したためと言える。
3.2. XAFS
これらガラスについてXAFSの測定を行った。その結果についてFig. 2に示す。Fig. 2の挿入図は、Feの pre-edgeに相当する7100―7120 eVの範囲を拡大して示したものである。ガラスCとガラスMでは、pre- edgeに差はあるもののEXAFS領域の振動にはほとんど差が確認できない。そこで、解析ソフトAthenaに Fig. 2のXAFSスペクトルを入力し、Feを中心とした各原子の動径分布関数を求めFig. 3に示した。なお、 Fig. 3では、同時に測定したFe-film中のFe-Fe距離を用いて横軸を補正しているが、参考文献(8)の図2ではそのような補正を行っていない点に留意いただきたい。
Fig. 3では、いずれのガラスについても1.5, 2.0, 2.8, 3.5Å付近にピークが観測された。このうち、1.5Åは解析による偽のピークと考えられる。偽ピークとは EXAFSスペクトルをフーリエ変換したときに打切りによる誤差として余分な振動が生じたものであり、本質的なピークではない。2Å付近のピークがFeに最も近いFe-Oの距離を表すピークと考えられる。そこで、このピーク位置をTable 2にまとめた。Table 2に示すようにガラスMが2.00Å、ガラスCが2.03Åと組成による差がわずかみられた。また、同時に測定したFeO(Wüstite)の結晶はFe-Oの距離は2.16Åであり、ガラス中のFe-Oの距離が結晶よりも小さいことが判った。
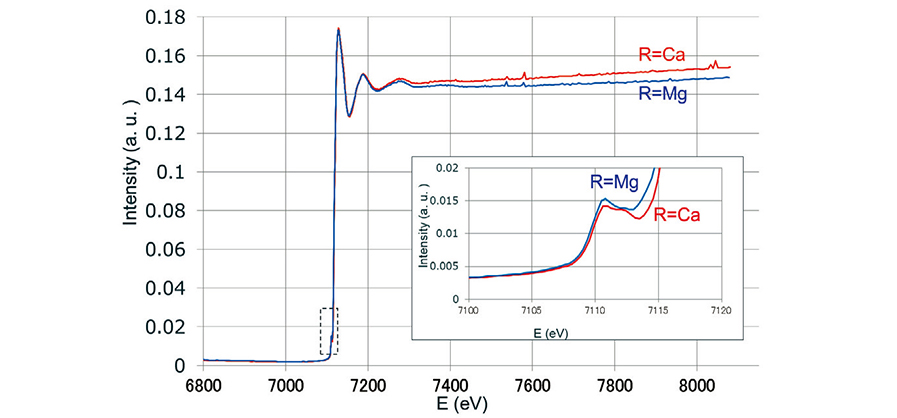 Fig. 2 XAFS spectra of MgO(Glass-M)and CaO glass(Glass-C).
Fig. 2 XAFS spectra of MgO(Glass-M)and CaO glass(Glass-C).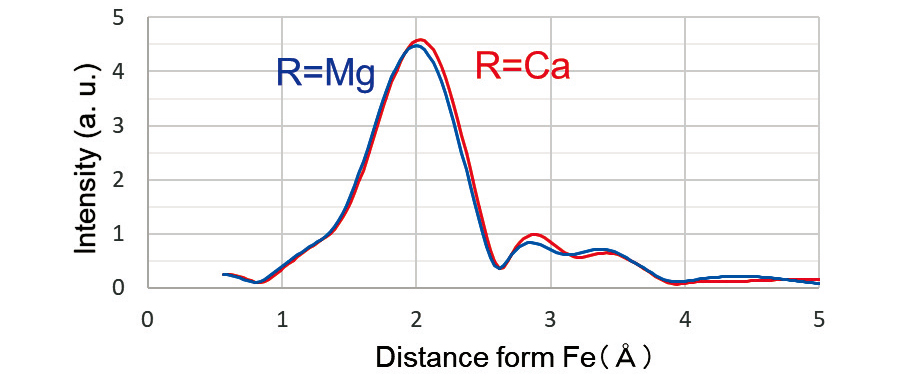 Fig. 3 Radial distribution functions of Fe in Glass-M and Glass-C.
Fig. 3 Radial distribution functions of Fe in Glass-M and Glass-C.
一方でXANES領域のpre-edgeからバックグランドを取り除いたスペクトルをFig. 4に示した。Fig. 4のスペクトルには,7113.8,7115.1,7117.1 eVの3つのピークがあることがわかった。また、最も高エネルギーの7117.1 eVのピークにアルカリ土類による差が見える。Vercamerら(6)はFe2+を含む結晶のXAFSの測定結果と第一原理計算との比較を行い、これらがよく一致することを報告している。この論文中で、 Fe2+の6配位の結晶(Siderite : C3v)は3つのピーク(7112, 7113, 7114.5 eV)を示すことが報告されいる。本報告との絶対値のずれはあるが、低エネルギー側の 2つのピークのエネルギー差(~1 eV)は、本報告のそれと同等である。しかし、高エネルギー側のピーク(本報告の7117.1 eV)は、本報告のピークが高エネルギー側にシフトしており、これは配位子場の対称性が低下することが原因ではないかと考える。また、ガラスCで高エネルギー側のピークが不明瞭になるのは、より対称性が低下することを示唆する。これらの検証のために、今後モデル計算により配位多面体の歪みが XAFSスペクトルに与える影響を評価していく予定である。
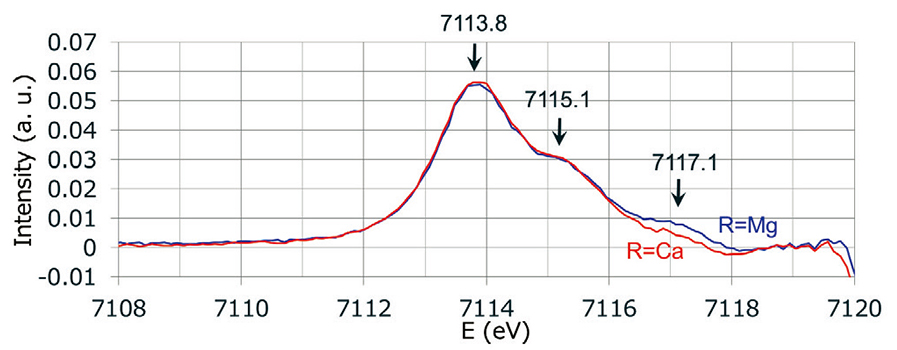 Fig. 4 XAFS spectra after removing the background of the absorption edge of Glass-M and Glass-C
Fig. 4 XAFS spectra after removing the background of the absorption edge of Glass-M and Glass-C3.3. XAFSと古典MDの動径分布の比較
Fig. 5に、ガラスCについてMD計算によるFe-O,Fe-Si, Fe-Na, Fe-Caそれぞれのイオン間距離を示した。Fe-Oは2Å, 3.6Å, 4.5Å付近にピークが見られる。 2Åは最近接の第一配位を表しており、3.6Å, 4.5Åは第二配位Fe-Oを示していると思われる。第二配位の2つのピークは酸素に配位している元素の違いであると考えられる。Naに配位している酸素との結合が3.6Å、 SiまたはCaに配位している酸素が4.5Åのピークに対応していると予想する。Fe-Na,Fe-Si,Fe-Caのイオン間距離については2.5~3.5Å付近に観察できる。Table 2にそれぞれのガラスの第一配位のFe-Oの距離を示した。
Fe-Oの距離について、XAFSと古典MDの結果を 比較するとよく一致していることがわかった。また、 Fig. 3の2.5~4.0Å付近に観察されているピークは、 Fig. 5からFe-Na,Fe-Si,Fe-Caであると考えられる。一方で第二配位Fe-OはXAFSでは観察されておらず、これはガラスのランダム性のためと思われる。
Fig. 6にガラスMとガラスCのMDによるFe-Oの動径分布を示す。2Å付近の第一配位の距離については XAFSと合わせてTable 2に示した。Fe-Oの距離についてはXAFSとMDで同じ組成依存性を示している。また、第一配位Fe-Oのピーク強度についてはガラス Mの方が低くなっており、これは第一配位の酸素数の低下を示唆する。
3.4. Fe2+イオンの局所構造にアルカリ土類イオンが与える影響
ガラスMとガラスCを比較したところ、UV-Vis.-IR測定においては10000 cm-1付近のピークがシフトすること、XANESのpre-edgeにおいては高エネルギー側のピーク形状が異なることが分かった。これまでに筆者は、これらのガラスについてFeのメスバウワー測定でFe2+はさまざまな状態の6配位を形成しており、ガラスMよりもガラスCの方がより歪んだ構造をしていることを報告(8)している。また同じ報告の中で、いずれのガラスも一部のFe2+は4配位として存在していることを定性的ではあるが報告(8)している。
一方で、MgOからCaOへの置換はガラスの光学的塩基度を増加させる方向である。一般的には光学的塩基度が上がると、中心にあるカチオンの酸化数が上がるか配位数を下げることが知られている。R2O-SiO2系のFe添加の系ではアルカリ種とアルカリ量を変化させ光学的塩基度を上げた時に、Feの酸化数が上がることが報告されている(16)。また、価数が変化しないNi2+を含むK2O-B2O3においてK2O量を増加させて光学的塩基度を上げた場合、6配位から4配位にNi2+の酸素配位数が低下することが報告されている(17)。
本報告ではFeの価数はすべて2価であることを確認しているが、光学的塩基度の増加に伴う4配位Feの増加は確認できていない。逆に、3.3節で示したように光学的塩基度の低いガラスMの方が第一配位の酸素数が少ないことを示す結果も得られている。これらの結果は、平均的な光学的塩基度からFeの配位多面体を予想したり、Feの配位多面体として対称性の高い配位多面体のみを考慮したりすることが、ガラス中の鉄イオンについては適当ではないことを示唆しており、今後より詳細なFe2+イオン周囲の構造解析が待たれる。
以上の結果から、ガラスMよりもガラスCの方が、第一配位のFe-O間距離が大きく、かつ酸素6配位の Fe2+イオン周囲がより歪んだ構造を取ることが示唆された。Fe2+イオンの配位数変化や配位多面体の歪みは p-d混成軌道形成の原因となるため、d-d遷移の禁制が解け遷移確率が大きくなり、吸収するエネルギーが変化する。したがって、これらのFe2+イオン周囲の構造が光吸収特性に与える影響は大きいと考えられる。
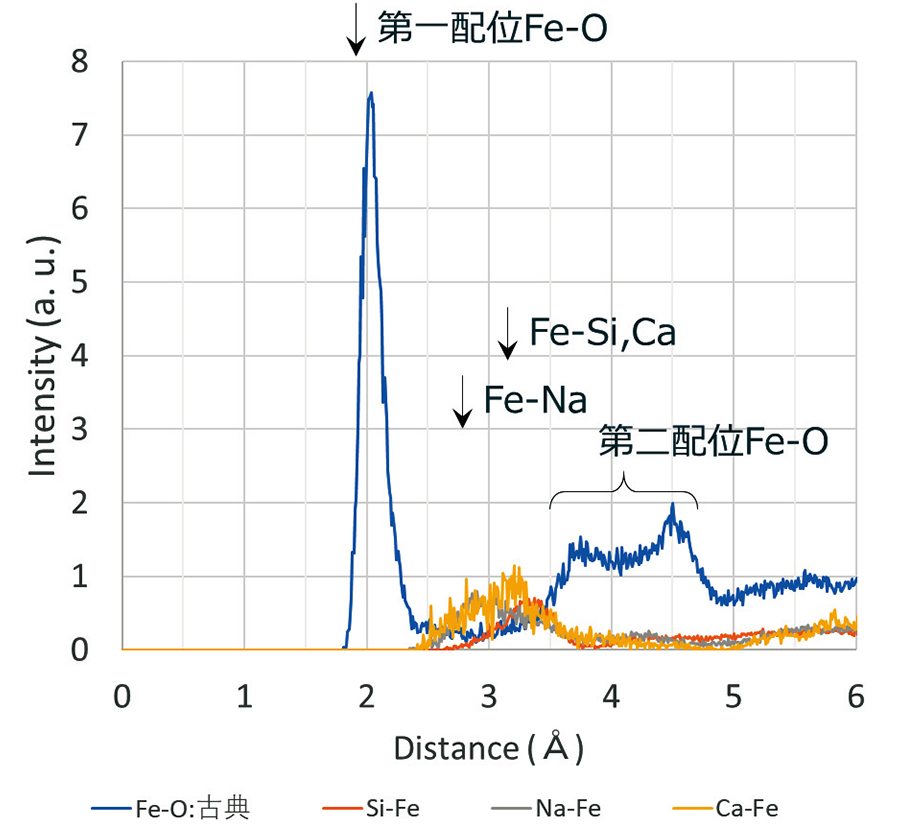 Fig. 5 Radial distribution functions of specific partial pairs obtained by MD calculation
Fig. 5 Radial distribution functions of specific partial pairs obtained by MD calculation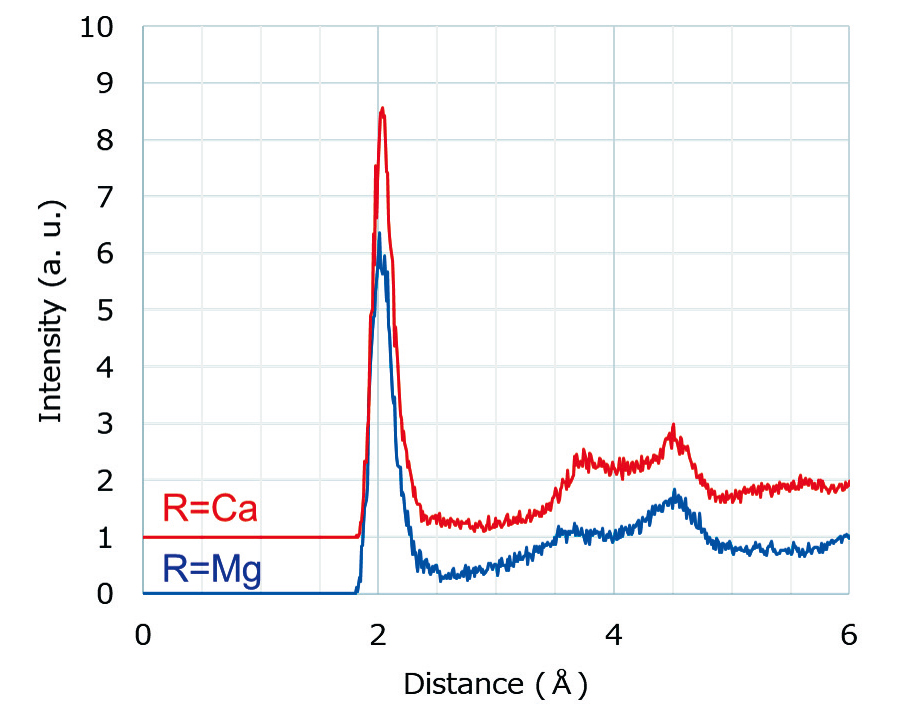 Fig. 6 Comparison of RDF between Glass-M and Glass-C obtained by MD calculation
Fig. 6 Comparison of RDF between Glass-M and Glass-C obtained by MD calculation4. 総括
16Na2O-10RO-74SiO2(mol%)(R=Mg, Ca)ガラスについてUV-Vis.-IR測定、XAFS、古典MDを用いて比較した。どの手法においてもアルカリ土類をMgOからCaOに置換することで第一配位のFe-O間距離が大きく、かつ酸素6配位のFe2+イオン周囲がより歪んだ構造を取ることを示唆する結果が得られた。
参考文献
- 長嶋廉仁,景山大輝,白木康一,岡田京子,大渕博宣,櫻井吉晴,梅咲則正,XAFSで明らかにするソーダライムガラス中の微量/低濃度/高濃度の鉄イオンの構造と光の吸収・着色の関係,SPring-8 重点産業化促進課題・一般課題(産業分野)実施報告書2013A1640,(2013)
- K. Sakaguchi, T. Uchino, Compositional dependence of infrared absorption of iron-doped silicate glasses, J. Non- Crystalline Solids , 353(52–54),(2007), 4753-4761 doi: 10.1016/j.jnoncrysol.2007.06.058
- 近藤裕己, 土屋博之, SPring-8利用報告書, 課題番号2010B3350(2010)
- 近藤裕己, 土屋博之, SPring-8利用報告書, 課題番号2010B3236(2010)
- 岡島敏浩, 西田晋作, 中根慎護, 梅咲則正, ガラス中に含まれる微量不純物評価への XANES スペクトル測定の適用, New Glass, 2(7 105),(2012), 8-14
- V. Vercamer, M. Hunault, G. Lelong, M. W. Haverkort, G. Calas, Y. Arai, H. Hijiya, L. Paulatto, C. Brouder, M. Arrio, and A. Juhin, Calculation of optical and K pre-edge abso rption spectra for ferrous iron of distorted sites in oxide crystals, Phys. Rev . B 94, 245115(2016)doi: 10.1103/Phys RevB.94.245115
- V. Vercamer, Spectroscopic and Structural Properties of Iron in Silicate Glasses, Ph.D. thesis, Universit´e Pierre et Marie Curie,(2015)
- 土屋博之, ガラス中のFe2+の構造に関する考察, New Glass, 34(127),(2019), 14-17
- L. Galoisy, G. Calas, M. A. Arrio, High-resolution XANES spectra of iron in minerals and glasses: structural infor mation from the pre-edge region, Chemical Geology 174,(2001), 307–319 doi:10.1016/S0009-2541(00)00322-3
- S. Nose, A unified formulation of the constant temperature molecular dynamics methods. J Chem Phys . , 8(1 1),(1984) 511–519 doi: 10.1063/1.447334
- M. Tuckerman, J. lejandre, R. Lopez-Rendon, A. Jochim , G. Martyna, A Liouville-operator derived measure pre serving integrator for molecular dynamics simulations in the isothermal–isobaric ensemble. J. Phys. A: Math. Gen . , 39,(2006), 5629-5651 doi:10.1088/0305-4470/39/19/S18
- Plimpton S. Fast parallel algorithms for short-range molecular dynamics. J Comput Phys . 11(7 1),(1995), 1–19.
- Du, A. Cormack, The medium range structure of sodium silicate glasses: a molecular dynamics simulation, J. Non- Cryst. Solids , 349,(2004), 66–79 doi: 10.1016/j.jnoncry sol.2004.08.264
- M. Hayashi, M. Hori, M Susa, H. Fukuyama, K. Nagata, Oxidation states and coordination structures of iron ions in silicate melts during relaxation process and at equilibrium, Phys. Chem,. Glasses , 2000, 41(2), 49-54
- T. T. Volotinen, J. M. Parker, P. A. Bingham, Concentra tions and site partitioning of Fe2+ and Fe3+ ions in a soda–lime–silica glass obtained by optical absorbance spec troscopy, Eur. J. Glass Sci. Technol . B, 49(5),(2008)258- 270
- F. G. K. Baucke, J. A. Duffy, The effect of basicity on redox equilibria in molten glasses, Phys. Chem. Glasses , 32
- A, Paul and R. W. Douglss, Co-ordination equilibria of nickel(II)in alkali borate glasses, Phys, Chem. Glasses , 8(6),(1967)233-237