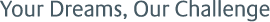AGC Research Report 73(2023)
Synthesis of Fluorinated Heterocycles Utilizing Reactivities of Hydrofluoroolefins(HFOs)
ハイドロフルオロオレフィン(HFO)の反応性を活用する含フッ素ヘテロ環化合物の合成
石橋雄一郎*・藤田健志**・市川淳士**
Yuichiro Ishibashi, Takeshi Fujita, and Junji Ichikawa
*AGC株式会社 材料融合研究所(yuichirou.ishibashi@agc.com)
**筑波大学 数理物質系 化学域(fujita@chem.tsukuba.ac.jp, junji@chem.tsukuba.ac.jp)
トリフルオロメチル基、ジフルオロメチル基などのフルオロアルキル基を有するヘテロ環化合物は、その特異な生理活性により医薬品や農薬の分野で注目されている。しかし、それらの工業的な製法は限られており、安全かつ大量製造が可能な含フッ素ヘテロ環化合物の製法が求められている。本研究では、安全かつ環境負荷の小さい市販のハイドロフルオロオレフィン(HFO)をビルディ ングブロックとして用い、様々な置換基を持つ多様なヘテロ環化合物を短工程で合成可能な、効率的製法の開発を行った。入手容易なHFO-1224yd(Z)またはHFO-1233yd(Z)と、オルト位にヘテロ元素求核部位を持つアリールボロン酸の鈴木−宮浦カップリングにより、それぞれβ-フルオロ-β-(トリフルオロメチル)スチレンおよびβ-(ジフルオロメチル)-β-フルオロスチレンを調製した。これらのスチレン誘導体を塩基で処理すると、分子内でのビニル位求核置換(SNV)反応による環化が進行し、トリフルオロメチル基やジフルオロメチル基を有する種々のヘテロ環化合物が得られた。本反応では、SNV反応とアリル位求核置換(SN2'型)反応が競争しうる基質においてもSNV反応のみが進行し、フルオロアルキル基を位置選択的に導入しながら、ヘテロ環構築が可能なことを明らかにした。さらに本反応は、環化の経験則であるBaldwin則において不利とされる5-endo-trig環化にも適用でき、2位にフルオロアルキル基を有するベンゾフラン、ベンゾチオフェン、およびインドールを位置選択的かつ効率的に合成できた。
Heterocyclic compounds with fluoroalkyl groups, such as trifluoromethyl and difluoromethyl groups, have become increasingly important in the pharmaceutical and agrochemical industries owing to their unique biological activities. However, there are limited industrial methods for producing these compounds, underscoring the need for new, safe, and large-scale synthetic methods for fluorinated heterocyclic compounds.
In this study, we developed an efficient method to synthesize various trifluoromethyl- and difluoromethyl-bearing heterocyclic compounds with diverse substituents. Our method employs commercially available hydrofluoroolefins(HFOs), which are safe and environmentally friendly building blocks. We achieved Suzuki–Miyaura coupling by combining readily available HFO-1224yd(Z)or HFO-1233yd(Z)with arylboronic acids(acid esters)that possess an oxygen, nitrogen, or sulfur nucleophilic moiety at the ortho position. This resulted in β-fluoro-β-(trifluoromethyl)styrenes or β-fluoro-β-(difluoromethyl) styrenes, respectively. Upon applying suitable bases, the produced styrene derivatives underwent cyclization through intramolecular nucleophilic vinylic substitution(SNV) reactions. This process resulted in various heterocyclic compounds with a trifluoromethyl or difluoromethyl group. During these reactions, we discovered that the SNV reaction takes precedence even when the SNV reaction and the allylic nucleophilic substitution(SN2'-type) reaction can compete. This allowed for the simultaneous creation of heterocycles and regioselective introduction of fluoroalkyl groups. Furthermore, we expanded this method to achieve 5-endo -trig cyclization, normally disfavored according to Baldwin's rules, leading to 2-trifluoromethylated and 2-difluoromethylated benzofurans, indoles, and benzothiophenes.
1. 緒言
有機化合物にフッ素を導入すると、物理的、化学的性質および生理活性が大きく変化するため、有機フッ素化合物は機能性材料や医薬品、農薬の分野で幅広く使用されている1。その中でも特に、トリフルオロメチル基やジフルオロメチル基といったフルオロアルキル基を有するヘテロ環は、医農薬分野における有望な部分構造として大きな注目を集めている。例えば、メチル基をトリフルオロメチル基で置換した化合物は、疎水性や代謝安定性が向上することから、医薬品や農薬に利用されている1a,b。一方ジフルオロメチル基は、水素結合供与能と疎水性を併せ持つユニークな置換基として、近年関心が高まっている(Fig.1)2。
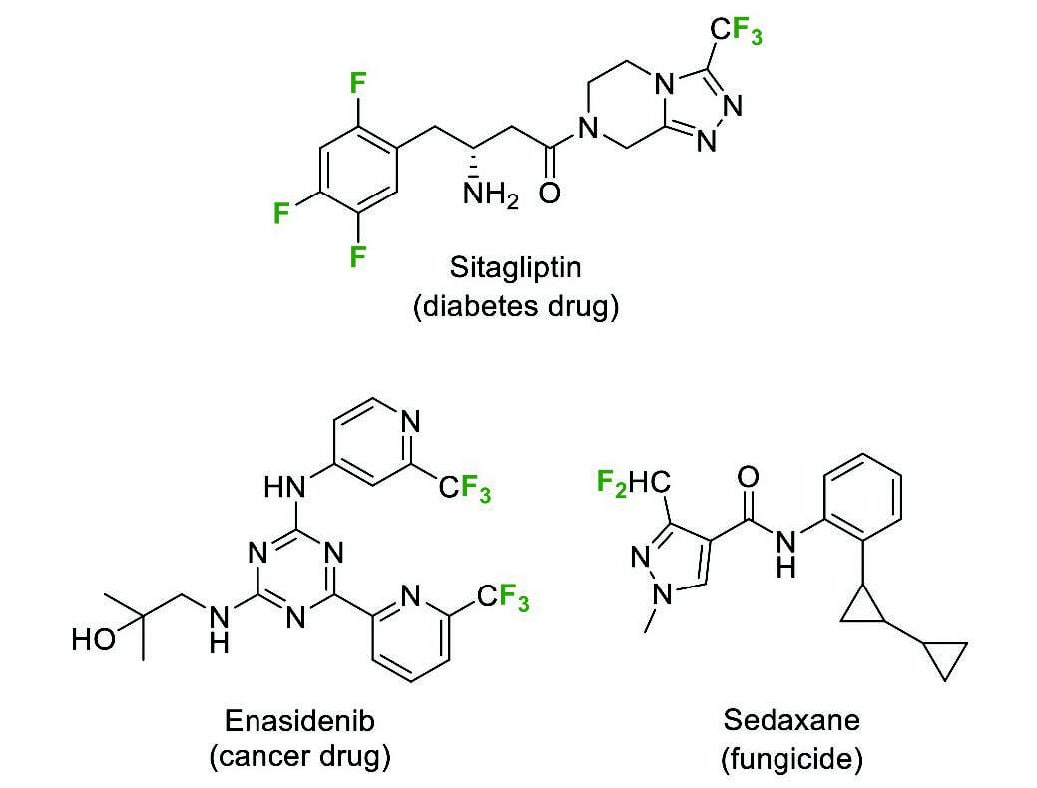 Fig.1 Some examples of fluoroalkylated heterocyclic compounds used as pharmaceuticals and agro- chemicals.
Fig.1 Some examples of fluoroalkylated heterocyclic compounds used as pharmaceuticals and agro- chemicals.有機フッ素化合物は天然にほとんど存在しないため、その入手には有機合成化学による手法が必要となる。有機フッ素化合物の工業的製法には、フッ素を持つ低分子を出発物質として複雑な有機フッ素化合物を合成するビルディングブロック法が知られている。たとえば、農薬中間体として重要なジフルオロメチル基を持つピラゾールカルボン酸を、ジフルオロ酢酸誘導体から短工程で合成する方法が報告されている(Scheme 1)3。しかし、ビルディングブロックとしての要件である、適切な反応性、安全性、および入手容易性を全て満たす既存の化合物はいまだ少ない。そのため、多様なフルオロアルキル置換ヘテロ環化合物を合成できるビルディングブロックが望まれている。
 Scheme 1 Syntheses of a pyrazolecarboxylic acid bearing difluoromethyl group from building blocks.
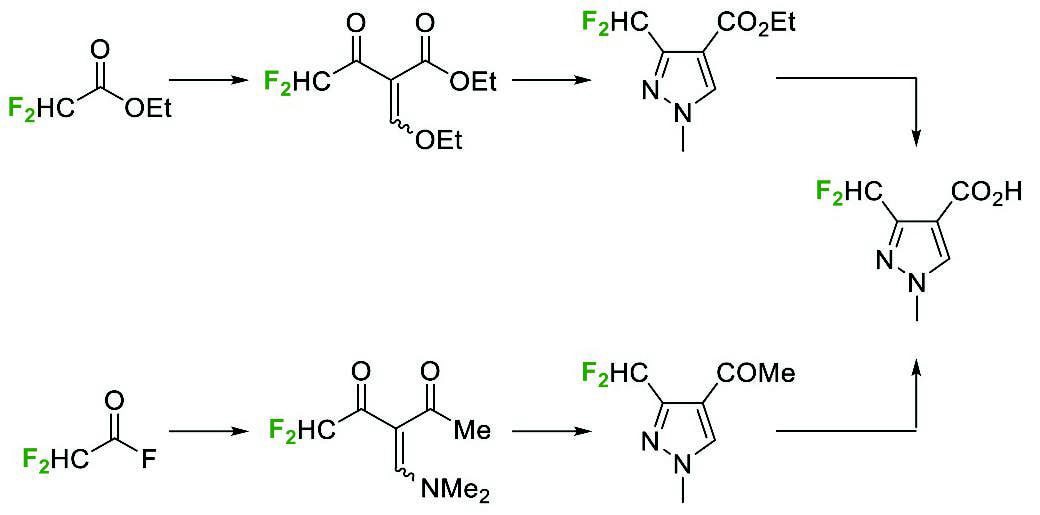
Scheme 1 Syntheses of a pyrazolecarboxylic acid bearing difluoromethyl group from building blocks.市川らは、分子内に求核部位を有する 1,1-ジフルオロ-1-アルケンの求核的ビニル位置換(SNV)反応を塩基性条件下で行うことにより、環炭素がフッ素化されたヘテロ環化合物の構築法をすでに開発している(Scheme 2a)4。この反応は、(i)フッ素の非共有電子対とオレフィンπ電子とのp–π反発による炭素-炭素二重結合の分極、(ii)フッ素のβ-アニオン安定化効果による中間体の安定化、および(iii)フッ素のフッ化物イオンとしての脱離能、といったフッ素由来の化学的性質を活用することで達成されている。この手法では、6-endo-trig環化による含フッ素ヘテロ六員環化合物の合成だけでなく、環化の経験則であるBaldwin則において不利とされる酸素および窒素求核種による5-endo-trig環化へ適用できることを見いだし、ベンゾヘテロールを含む各種ヘテロール類の合成にも成功している5,6。
 Scheme 2 Syntheses of fluorine-containing heterocycles via nucleophilic endo cyclizations
Scheme 2 Syntheses of fluorine-containing heterocycles via nucleophilic endo cyclizations我々は、次なる挑戦として、環炭素上にトリフルオロメチル基やジフルオロメチル基を有するヘテロ環化合物3および4の合成を目指した(Scheme 2b)。ビニル位にフルオロアルキル基およびフッ素置換基を有するスチレン5および6の分子内SNV反応が進行すれば、3、4がそれぞれ得られる。また、次世代冷媒や溶剤として開発、上市されたHFO-1224yd(Z)(1)、HFO-1233yd(Z)(2)を出発物質として、5および6を合成することができれば、工業的製法にもつながる3、4の新規合成法になると考えた。しかし、同一ビニル炭素上にフルオロアルキル基とフッ素置換基を持つスチレン 5、6の合成例はこれまでになく、その反応性も不明であった。そこで、(1)HFOを原料に用いる環化前駆体 5、6の調製、(2)5、6の分子内SNV反応を利用する環化、の2工程を経る含フッ素ヘテロ環化合物の合成法開発に着手した。
2. 実験結果と考察
2.1. β-フルオロ-β-(トリフルオロメチル)スチレンの調製
まず、HFO-1224yd(Z)(1)とアリールボロン酸7の鈴木-宮浦カップリングによるβ-フルオロ-β-(トリフルオロメチル)スチレン5の調製を行った。二重結合上にトリフルオロメチル基を持つ塩化ビニル誘導体による鈴木-宮浦カップリングの例はほとんど知られていないが7、配位子を検討した結果、XPhosを用いることで反応が円滑に進行することを見出した。触媒量のPd2(dba)3およびXPhosの存在下、1に対してヒドロキシ基、カルボキシ基、またはメチルスルファニル基を有するアリールボロン酸7a–7iを作用させたところ、酸素求核部位を持つβ-フルオロ-β-(トリフルオロメチル)スチレン5a–5h、硫黄求核部位を持つ5iがそれぞれ高収率で得られた(Table 1)。この反応において、基質中の炭素-ハロゲン結合のうち置換されたのは1のビニルC–Cl結合のみであり、1のビニルC–F結合、アリルC–F結合(entry 3)、および5d–5fのアリールC–Cl結合(entries 5–7)は反応前後で変化しなかった。また、この反応においてはアルケン部位の立体化学は保持され、5はZ体のみが生成した。
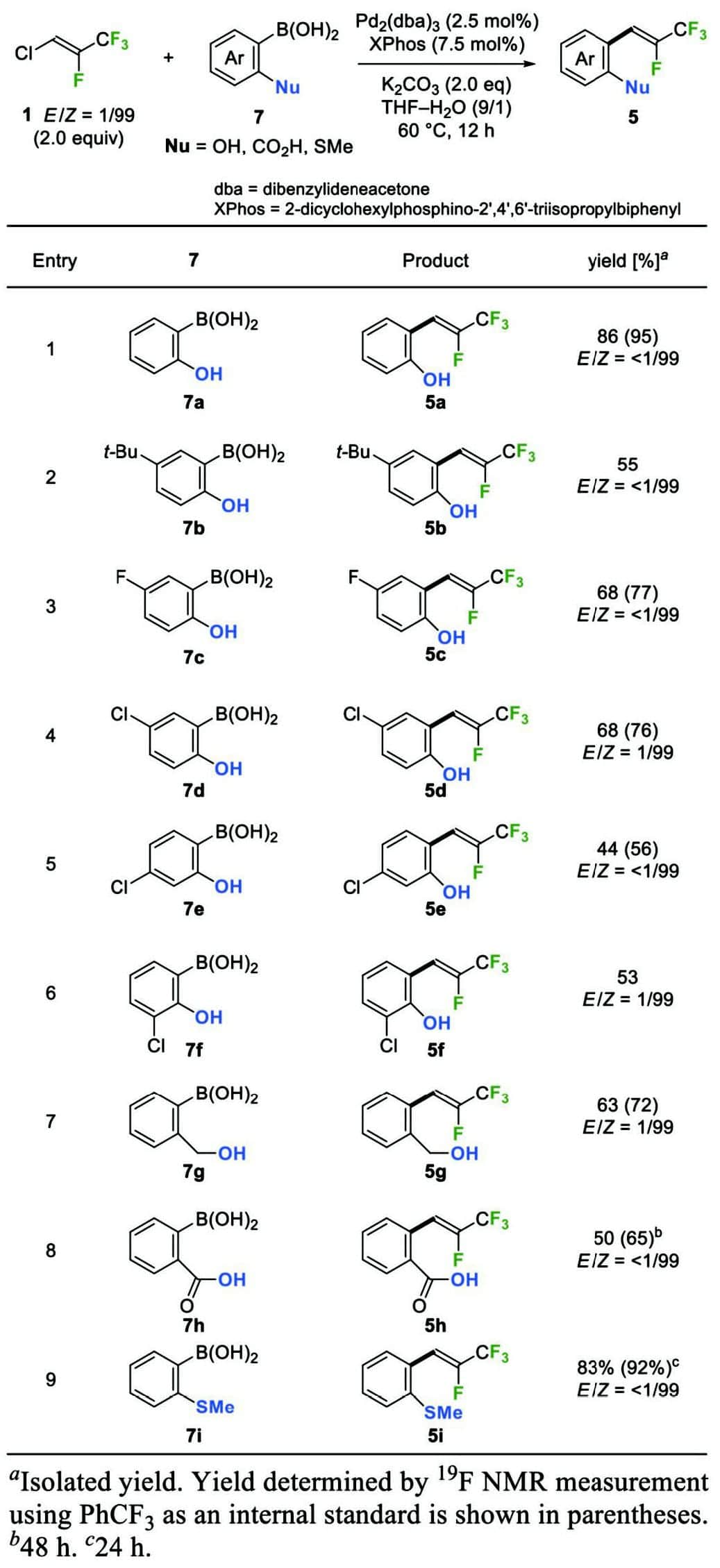
続いて、窒素求核部位として、β,β-ジフルオロスチレンの5-endo-trig環化で高い反応性を示したトシルアミド基を選択し、環化前駆体の調製を行った4。(トシルアミド)スチレン5j–5lは、アミノ基を有するアリールボロン酸(またはそのピナコールエステル)7j–7lを用いて1との鈴木-宮浦カップリングを行った後に、アミノ基をトシル化することにより容易に調製できた(Scheme 3)。この反応においても、アルケン部位の異性化は見られず、5のZ体のみが得られた。
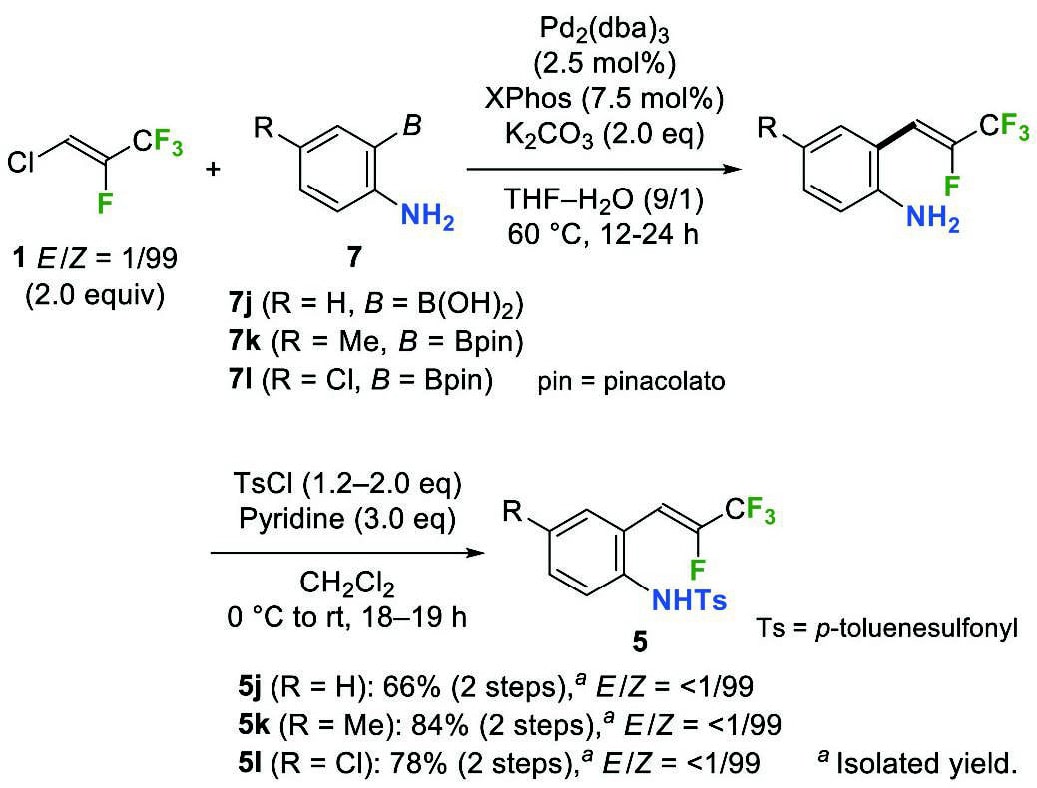 Scheme 3 Preparation of β-fluoro-β-(trifluoromethyl)- styrenes 5j–5l bearing N -substituent.
Scheme 3 Preparation of β-fluoro-β-(trifluoromethyl)- styrenes 5j–5l bearing N -substituent.2.2. トリフルオロメチル基を有するヘテロ環化合物の合成
2.2.1. 環化条件の最適化
次に、ヒドロキシスチレン5bを用いて、5-endo-trig環化の最適条件を調べた(Table 2)。N,N-ジメチルアセトアミド(DMA)中、塩基としてジアザビシクロウンデセン(DBU)または炭酸カリウムを作用させたところ、目的物である2-(トリフルオロメチル)ベンゾフラン3bが得られたものの、低収率にとどまった(entries 1, 2)。一方、塩基を水素化ナトリウムまたはリン酸カリウムに変更すると、3bの収率が大幅に向上した(entries 3, 4)。用いる塩基をリン酸カリウムとして溶媒をスクリーニングした結果、DMAより極性の低いクロロベンゼンや1,4-ジオキサン中ではほとんど反応が進行しないものの、ジメチルスルホキシド(DMSO)を溶媒に用いた際に3bがほぼ定量的に得られることが分かった(entries 4–7)。ただし、反応温度を60℃に下げると、反応はほとんど進行しなかった(entry 8)。
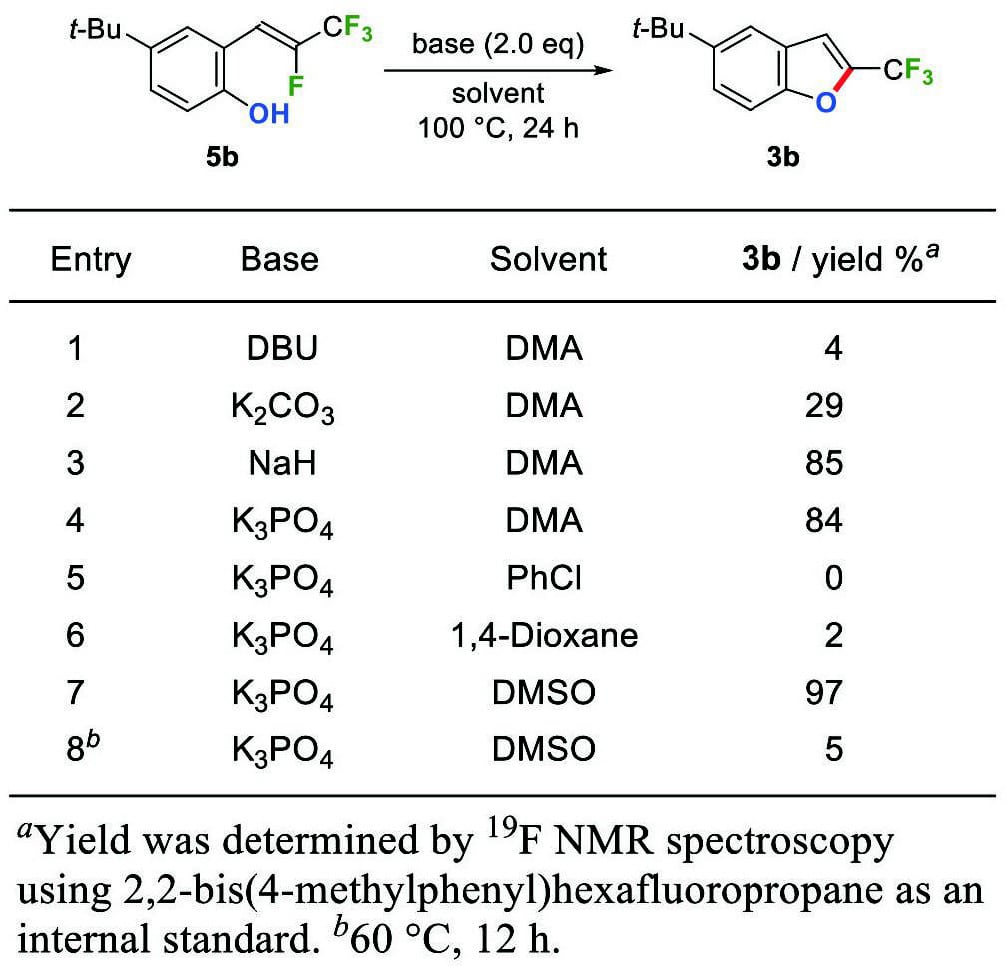
2.2.2. 5-endo-trig環化によるベンゾフラン合成
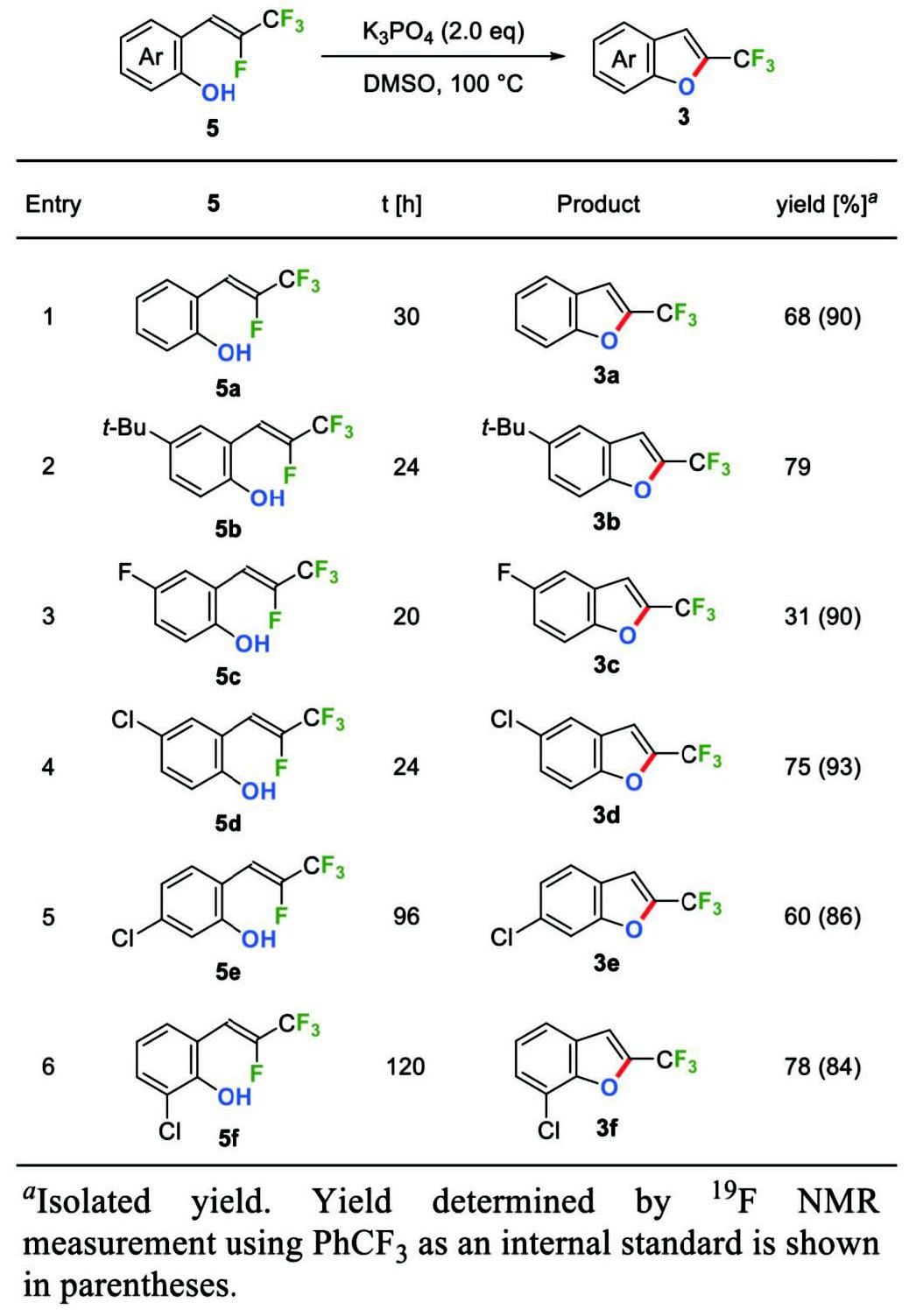
以上のように決定した最適条件を用いて、ヒドロキシスチレン5の基質一般性を検討した(Table 3)。ヒドロキシスチレン5aに対してDMSO中でリン酸カリウムを作用させると、5-endo-trig環化が円滑に進行し、2-(トリフルオロメチル)ベンゾフラン(3a)が90%の収率で生成した(entry 1)。tert-ブチル基を有する(トリフルオロメチル)ベンゾフラン3bは、79%の単離収率で得られた(entry 2)。芳香環上のフッ素置換基は求核攻撃を受け易いことが知られるが、ヒドロキシ基のパラ位にフッ素置換基を有する5cの環化においては、ベンゼン環上のフッ素置換基の反応は全く起きず、望みのSNV反応のみが選択的に進行し、対応するベンゾフラン3cを90%の収率で与えた(entry 3)。なお、3cの単離収率は低沸点のため低下した。芳香環上の異なる位置に塩素置換基を有するヒドロキシスチレン5d–5fにおいても、対応するベンゾフラン3d–3fをそれぞれ93%、86%、84%の高収率で与えた(entries 4–6)。本系において、通常困難な5-endo-trig環化が広範な基質において円滑に進行したことは、アルケン炭素に直接フッ素置換基を導入することにより、緒言でも述べたフッ素由来の化学的性質(i)~(iii)を基質が獲得したことを示唆している。
2.2.3. 6-endo-trig環化によるイソクロメン、イソクマリン合成
続いて、ベンジル位に酸素求核部位を持つβ-フルオロ-β-(トリフルオロメチル)スチレン5gおよび5hの環化反応を検討した。市川らは、α-(トリフルオロメチル)スチレン8のSN2'型反応を経る5-endo-trig環化により、exo-ジフルオロメチレン基を有するヘテロ五員環化合物9が生成することを報告している(Scheme 4)8。β-フルオロ-β-(トリフルオロメチル)スチレン5gと5hの反応において、望みのSNV反応は6-endo-trig環化であり、SN2'型反応は5-exo-trig環化となるが、これらはいずれもBaldwin則において有利とされる5。したがって、5gと5hの反応において、SNV反応とSN2'型反応の選択性に興味が持たれる(Scheme 5)。
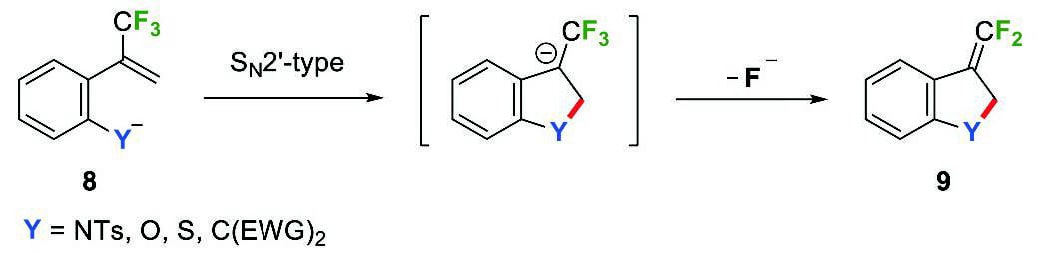 Scheme 4 Synthesis of five-membered heterocycles 9 bearing exo- difluoromethylene group.
Scheme 4 Synthesis of five-membered heterocycles 9 bearing exo- difluoromethylene group.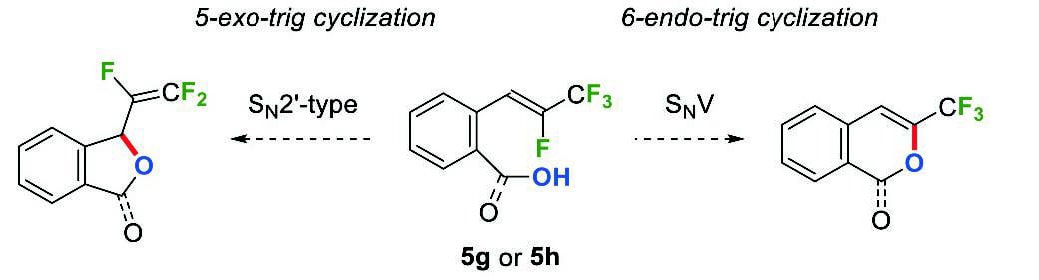 Scheme 5 6-endo-trig vs. 5-exo-trig cyclizations of 5g and 5h.
Scheme 5 6-endo-trig vs. 5-exo-trig cyclizations of 5g and 5h.まず、β-フルオロ-β-(トリフルオロメチル)スチレン5gをリン酸カリウムで処理したところ、6-endo-trig環化のみが選択的に進行し、トリフルオロメチル基を有する1H-イソクロメン3gが収率85%で得られた。ここでは、5-exo-trig環化生成物である1-(トリフルオロビニル)-1,3-ジヒドロイソベンゾフランは全く生成しなかった(Scheme 6)。この高い位置選択性もやはり、ビニル位フッ素の非共有電子対とアルケンπ電子の反発によるアルケンの分極が大きいためと考えている。同様に、5hに対して塩基としてトリエチルアミンを作用させると、6-endo-trig環化が選択的に進行し、3-(トリフルオロメチル)イソクマリン(3h)のみが収率97%で生成した。
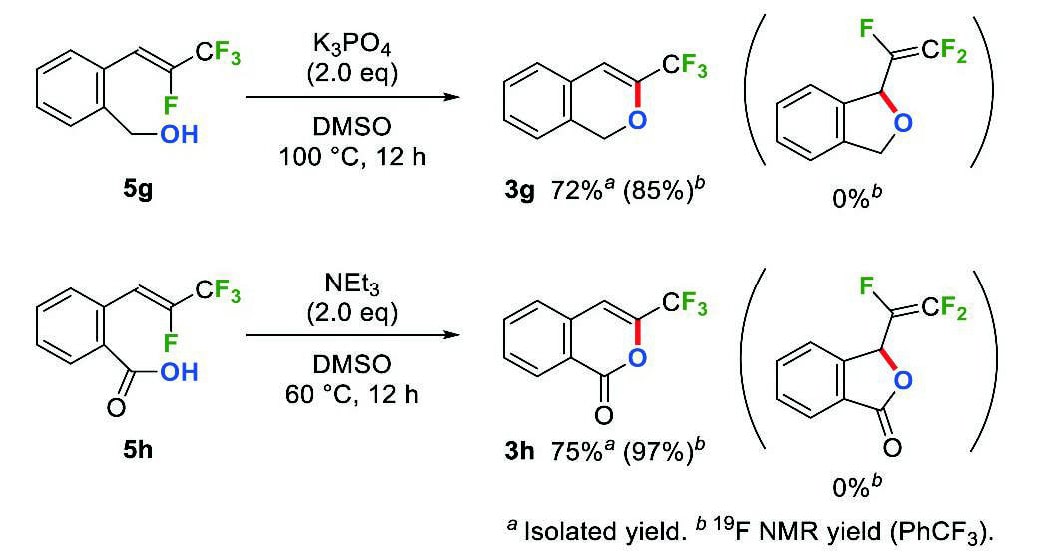 Scheme 6 Synthesis of 3-(trifluoromethyl)isochromene(3g)and 3-(trifluoromethyl)isocoumarin(3h)
Scheme 6 Synthesis of 3-(trifluoromethyl)isochromene(3g)and 3-(trifluoromethyl)isocoumarin(3h)2.2.4. 5-endo-trig環化によるインドール合成
(トシルアミド)スチレン5jの5-endo-trig環化は、DMA中140℃でリン酸カリウムを作用させることにより進行し、トシル基の脱離した2-(トリフルオロメチル)インドール(3j)が85%の収率で生成した(Scheme 7)。また、メチル基および塩素置換基を有する(トシルアミド)スチレン5kおよび5lからは、対応するインドール3kおよび3lをそれぞれ83%および 85%の収率で合成することができた。
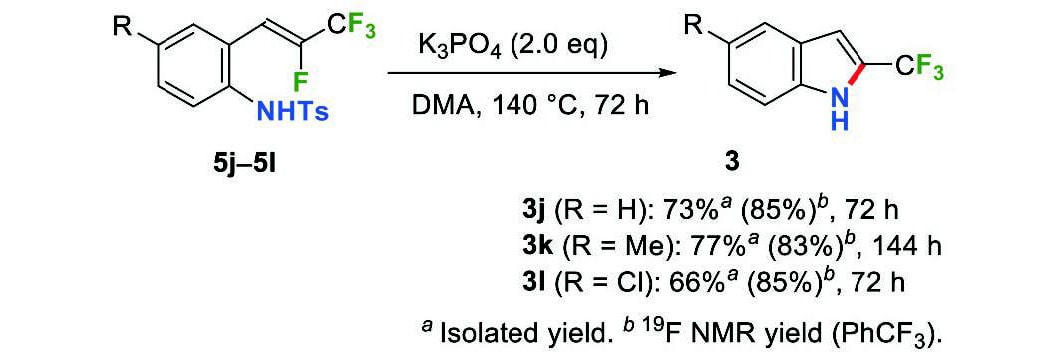 Scheme 7 Synthesis of 2-(trifluoromethyl)indoles 3j–3l.
Scheme 7 Synthesis of 2-(trifluoromethyl)indoles 3j–3l.2.2.5. 5-endo-trig環化によるベンゾチオフェン合成
さらに、硫黄を求核剤とするβ-フルオロ-β-(トリフルオロメチル)スチレンの 5-endo-trig環化にも取り組んだ。環化前駆体として考えられるアリールチオール類は扱い難いため、入手容易なo-(メチルスルフィニル)スチレン10iの利用を考えた4c,f。o-(メチルスルファニル)スチレン5iのmCPBA酸化により調製した10iにトリフルオロ酢酸無水物を作用させると、Pummerer転位が進行して中間体のトリフルオロアセ トキシメチルスルフィド11iが生成した。続いて炭酸カリウムを作用させることにより、反応系内で発生したチオラートの環化が進行し、2-(トリフルオロメチル)ベンゾチオフェン(3i)を84%の収率で与えた(Scheme 8)。
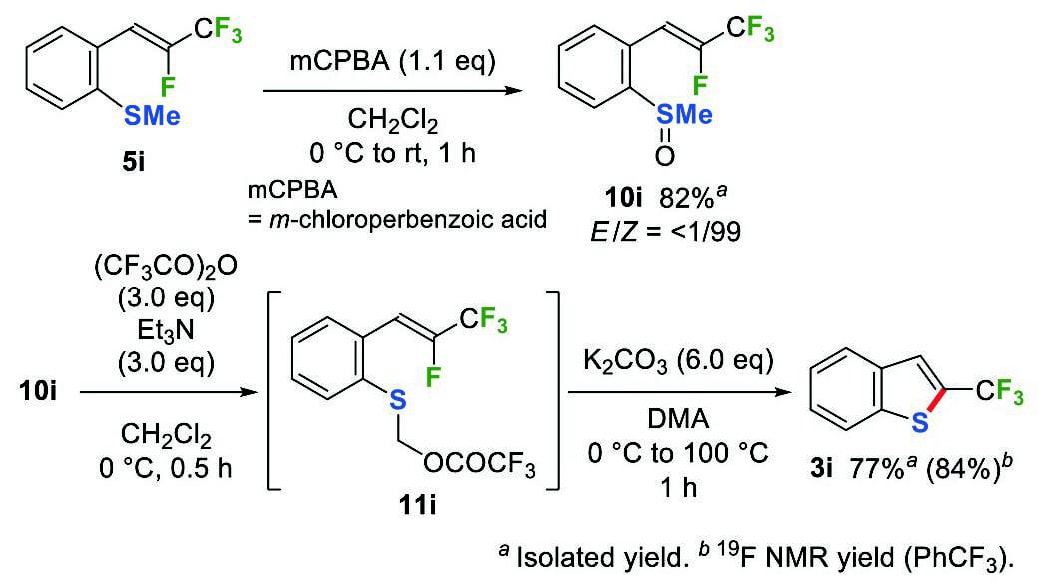 Scheme 8 Synthesis of 2-(trifluoromethyl)benzothiophene(3i).
Scheme 8 Synthesis of 2-(trifluoromethyl)benzothiophene(3i).2.3. ジフルオロメチル基を有するベンゾヘテロールの合成
緒言で述べたように、ジフルオロメチル基はその特異な性質により医薬・農薬分野で注目を集めている。そのため、ジフルオロメチル基の導入法に関する研究が数多く行われているものの、効率的な導入法はいまだ限られている9。我々は、ジフルオロメチル基を有するビルディングブロックとしてHFO-1233yd(Z)(2)を利用することにより、先と同様2位にジフルオロメチル基を有するインドールおよびベンゾチオフェンの位置選択的な合成に成功した。HFO-1233yd(Z)(2)と2-アミノフェニルボロン酸(7j)の鈴木-宮浦カップリングを行った後、トシル化によりβ-(ジフルオロメチル)-β-フルオロ-o-(トシルアミド)スチレン(6j)を調製した(Scheme 9)。6jの5-endo-trig環化において、トリフルオロメチル基を持つ類縁体5jの環化と同じく2倍モル量のリン酸カリウムを用いる条件(Scheme 7)で反応を行ったところ、6jの分解が観察された。これは、6jのジフルオロメチル基の脱プロトンが進行したためと考え、アミノ基の脱プロトンのみが進行するように塩基を小過剰量の水素化ナトリウムに変更した。その結果、マイクロ波(MW)照射下、6jの5-endo-trig環化が円滑に進行し、2-(ジフルオロメチル)-N-トシルインドール(4j)を収率84%で得た。また、(トリフルオロメチル)ベンゾチオフェン3iの合成と同様の手法で、(ジフルオロメチル)ベンゾチオフェン4iも合成できた。すなわち、2と7iの鈴木-宮浦カップリングおよびmCPBA酸化によりo-(メチルスルフィニル)スチレン13iを調製し、続いて13iの Pummerer転位を経て対応するチオラートの環化を行うことで、2-(ジフルオロメチル)ベンゾチオフェン(4i)が79%の収率で得られた(Scheme 10)。
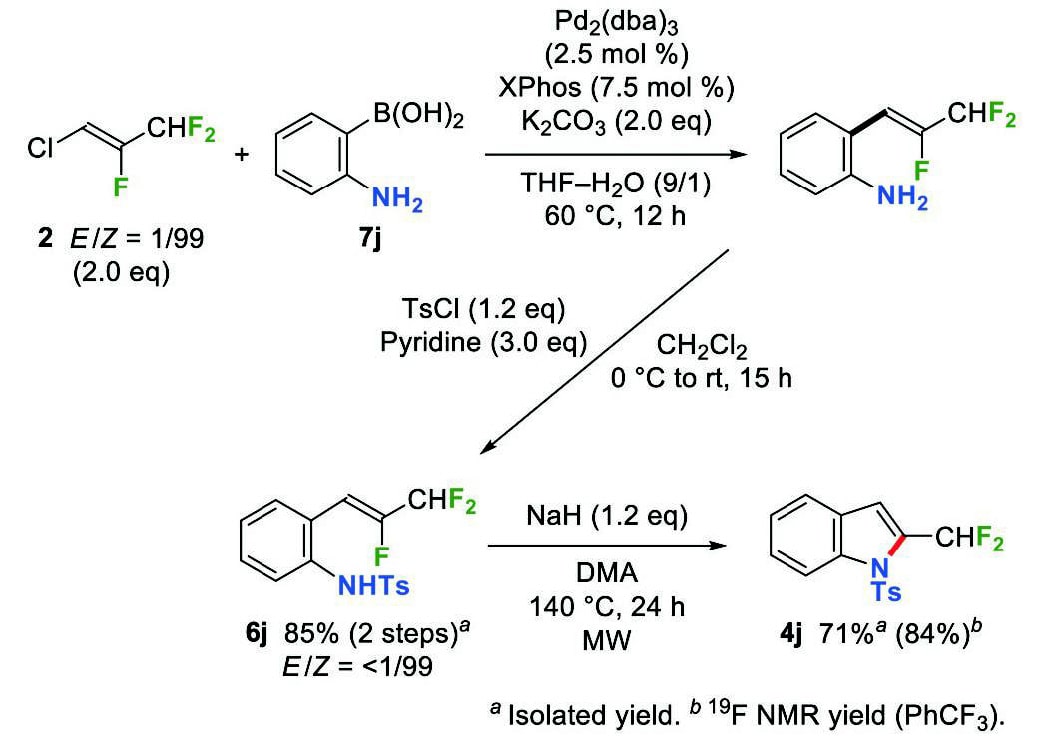 Scheme 9 Synthesis of 2-(difluoromethyl)-N -tosylindole(4j).
Scheme 9 Synthesis of 2-(difluoromethyl)-N -tosylindole(4j).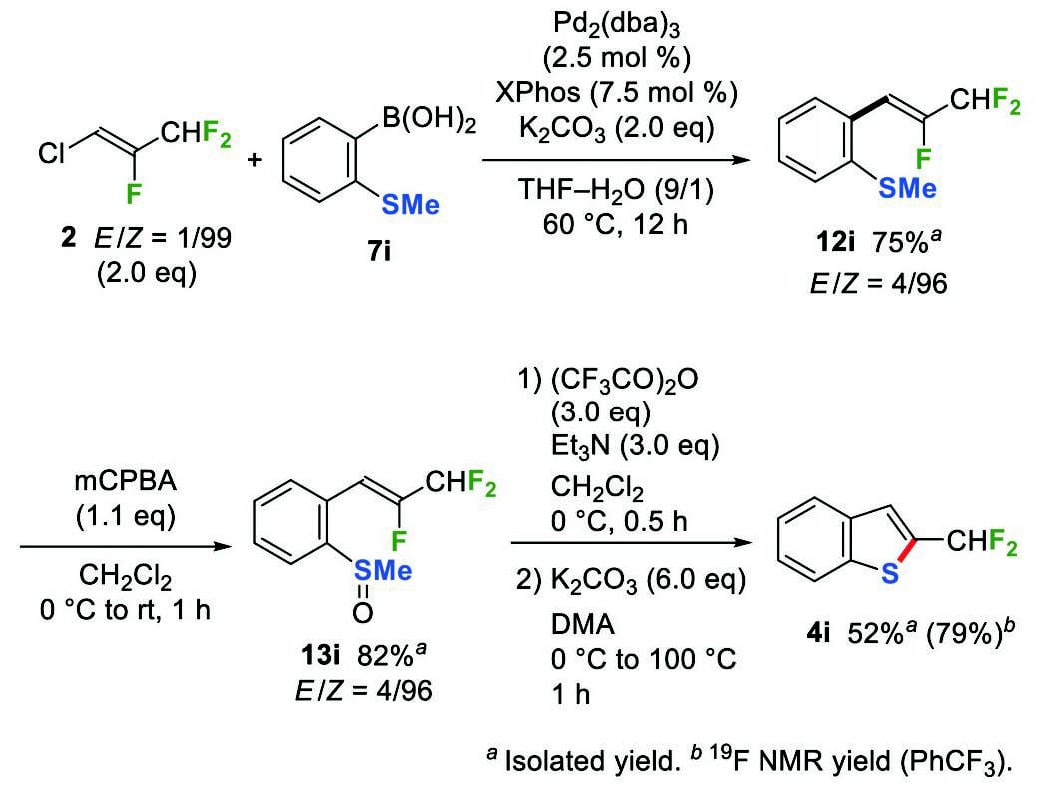 Scheme 10 Synthesis of 2-(difluoromethyl)benzothiophene(4i).
Scheme 10 Synthesis of 2-(difluoromethyl)benzothiophene(4i).3. 総括
我々は本研究において、市販の2種類のHFOを原料として用い、トリフルオロメチル基またはジフルオロメチル基を有するヘテロ環化合物を効率的に合成する方法を開発した(Scheme 11)。本合成法は、(a)フルオロアルキル基を持つビルディングブロックとして、安全で工業的に入手可能な2種類のHFOを用いる点、および(b)ヘテロ環骨格の構築と位置選択的なフルオロアルキル基の導入10,11を一挙に行うことにより、多様な構造の含フッ素ヘテロ環化合物を短工程で合成できる点で、優れた手法と言える。また本反応は、Baldwin則で不利とされる5-endo-trig環化にも適用でき、2-トリフルオロメチル基および2-ジフルオロメチル基を有する各種ベンゾヘテロールの合成方法としても有用である。今後の展望として、さらなる基質の展開により、医薬品や農薬中間体の合成へ応用が期待される12。
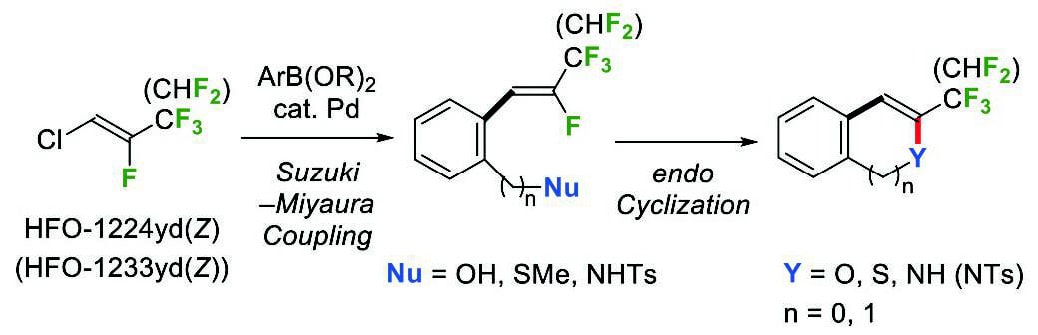 Scheme 11 Synthesis of heterocycles with trifluoromethyl or difluoromethyl group using commercially available HFOs.
Scheme 11 Synthesis of heterocycles with trifluoromethyl or difluoromethyl group using commercially available HFOs.4. 実験項
(Z)-2-(2,3,3,3-テトラフルオロプロパ-1-エン-1-イル)フェノール(5a)
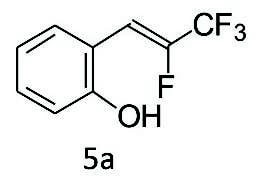
(2-ヒドロキシフェニル)ボロン酸(7a, 0.55g, 4.0mmol)、Pd2(dba)3(0.090g, 0.098mmol)、XPhos(0.15g, 0.30mmol)、炭酸カリウム(1.1g, 8.0mmol)、テトラヒドロフラン(THF, 30mL)、および水(4.0mL)の混合物に、HFO-1224yd(Z)(1、1.34MのTHF溶液、6.0mL、8.0mmol)を加え、60℃で12時間撹拌した。その後、飽和塩化アンモニウム水溶液(40mL)を加えて反応を停止した。有機物をジエチルエーテル(40mL)で2回抽出し、合わせた有機相を飽和食塩水(40mL)で洗浄し、硫酸ナトリウムで乾燥した。減圧下で溶媒を除去した後、粗体をシリカゲルカラムクロマトグラフィー(ヘキサン/ジクロロメタン = 70/30~50/50)で精製し、5a(0.71g、収率86%)を橙色の油状物として得た。
2-(トリフルオロメチル)ベンゾフラン(3a)
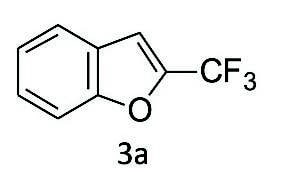
化合物5a(0.21g, 1.0mmol)のDMSO(30mL)溶液にリン酸カリウム(0.43g, 2.0mmol)を加え、100℃で30時間撹拌した。その後、5%食塩水(30mL)を加えて反応を停止した。有機物をジエチルエーテル(30mL)で3回抽出し、合わせた有機相を水(30mL)および飽和食塩水(30mL)で洗浄し、硫酸ナトリウムで乾燥した。減圧下で溶媒を除去した後、粗体をシリカゲルカラムクロマトグラフィー(ペンタン)で精製して、3a(0.13g、68%)を無色の油状物として得た。
参考文献
- (a)Inoue, M.; Sumii, Y.; Shibata, N. ACS Omega 2020, 5, 10633–10640.(b)Ogawa, Y.; Tokunaga, E.; Kobayashi, O.; Hirai, K.; Shibata, N. iScience 2020, 23, 101467.(c)Drobny, J. G. Technology of Fluoropolymers(2nd Ed.), CRC Press, 2008.
- Erickson, J. A.; McLoughlin, J. I. J. Org. Chem. 1995, 60, 1626–1631.
- Giornal, F.; Pazenok, S.; Rodefeld, L.; Lui, N.; Vors, J.; Leroux, F. R. J. Fluorine Chem. 2013, 152, 2–11.
- (a)Ichikawa, J.; Wada, Y.; Okauchi, T.; Minami, T. Chem. Commun. 1997, 1537–1538.(b)Ichikawa, J.; Fujiwara, M.; Wada, Y.; Okauchi, T.; Minami, T. Chem. Commun. 2000, 1887–1888.(c)Ichikawa, J.; Wada, Y.; Fujiwara, M.; Sakoda, K. Synthesis 2002, 1917–1936.(d)Fujita, T.; Sakoda, K.; Ikeda, M.; Hattori, M.; Ichikawa, J. Synlett 2013, 24, 57–60.(e)Fujita, T.; Ikeda, M.; Hattori, M.; Sakoda, K.; Ichikawa, J. Synthesis 2014, 46, 1493–1505.(f)Fuchibe, K.; Fushihara, T.; Ichikawa, J. Org. Lett. 2020, 22, 2201–2205.(g)Morioka, R.; Fujita, T.; Ichikawa, J. Helv. Chim. Acta 2020, 103, e2000159.(h)Fujita, T.; Fukuda, T.; Suzuki, N.; Ichikawa, J. Eur. J. Org. Chem. 2022, e202200600.
- For Baldwin’s rules, see:(a)Baldwin, J. E. J. Chem. Soc., Chem. Commun. 1976, 734–736.(b)Baldwin, J. E.; Cutting, J.; Dupont, W.; Kruse, L.; Silberman, L.; Thomas, R. C. J. Chem. Soc., Chem. Commun. 1976, 736–738.
- For recent reports on nucleophilic 5-endo-trig cyclization, see:(a)Tong, K.; Tu, J.; Qi, X.; Wang, M.; Wang, Y.; Fu, H.; Pittman, C. U., Jr.; Zhou, A. Tetrahedron 2013, 69, 2369– 2375.(b)En, D.; Zou, G.-F.; Guo, Y.; Liao, W.-W. J. Org. Chem. 2014, 79, 4456–4462.(c)Johnston, C. P.; Kothari, A.; Sergeieva, T.; Okovytyy, S. I.; Jackson, K. E.; Paton, R. S.; Smith, M. D. Nat. Chem . 2015, 7, 171–177.(d)Kapoorr, R.; Singh, S. N.; Tripathi, S.; Yadav, L. D. S. Synlett 2015, 26, 1201–1206.(e)Sharma, K.; Wolstenhulme, J. R.; Painter, P. P.; Yeo, D.; Grande-Carmona, F.; Johnston, C. P.; Tantillo, D. J.; Smith, M. D. J. Am. Chem. Soc. 2015, 137, 13414–13424.(f)Williams, B. M.; Trauner, D. Angew. Chem., Int. Ed . 2016, 55, 2191–2194.(g)Markwell-Heys, A. W.; George, J. H. Org . Biomol. Chem. 2016, 14, 5546–5549.(h)Xiao, T.; Li, L.; Zhou, L. J. Org. Chem. 2016, 81, 7908–7916.(i)Zhang, B.; Zhang, X.; Hao, J.; Yang, C. Org. Lett. 2017, 19, 1780–1783.(j)Hao, J.; Milcent, T.; Retailleau, P.; Soloshonok, V. A.; Ongeri, S.; Crousse, B. Eur. J. Org. Chem. 2018, 3688– 3692.(k)Zhang, X.; He, J.; Cao, S. Asian J. Org. Chem. 2019, 8, 279–282.
- Li, Y.; Zhao, B.; Dai, K.; Tu, D.; Wang, B.; Wang, Y.; Liu, Z.; Liu, Z.; Lu, J. Tetrahedron 2016, 72, 5684–5690.
- Ichikawa, J.; Iwai, Y.; Nadano, R.; Mori, T.; Ikeda, M. Chem.–Asian J. 2008, 3, 393–406.
- For reports on the synthesis of 2(- difluoromethyl)- benzoheteroles via direct difluoromethylation, see:(a) Deng, X.-Y.; Lin, J.-H.; Xiao, J.-C. Org. Lett. 2016, 18, 4384–4387.(b)Lu, C.; Gu, Y.; Wu, J.; Gu, Y.; Shen, Q. Chem. Sci. 2017, 8, 4848–4852.(c)Hori, K.; Motohashi, H.; Saito, D.; Mikami, K. ACS Catal . 2019, 9, 417–421.(d)Gedde, O. R.; Bonde, A.; Golbækdal, P. I.; Skrydstrup, T. Chem.–Eur. J. 2022, 28, e20220097.
- For reports on the synthesis of 2-(trifluoromethyl)- benzoheteroles via cyclization, see:(a)Wang, Z.; Ge, F.; Wan, W.; Jiang, H.; Hao, J. J. Fluorine Chem. 2007, 128, 1143–1152.(b)Kino, T.; Nagase, Y.; Horino, Y.; Yamakawa, T.mol. Catal. A Chem. 2008, 282, 34–51.(c)Zhou, H.; Niu, J.; Xu, J.; Hu, S. Synth. Comm. 2009, 39, 716–732.(d)Li, C.; Zhang, X.; Tang, R.; Zhong, P.; Li, J. J. Org. Chem. 2010, 75, 7037–7040.(e)Sun, L.-L.; Deng, C.-L.; Tang, R.-Y.; Zhang, X.-G. J. Org. Chem. 2011, 76, 7546–7550.(f)Pedroni, J.; Cramer, N. Org. Lett. 2016, 18, 1932–1935.(g)Ye, Y.; Cheung, K. P. S.; He, L.; Tsui, G. C. Org. Lett. 2018, 20, 1676–1679.(h)Walewska-Królikiewicz, M.; Wilk, B.; Kwast, A.; Wróbel, Z. Tetrahedron Lett. 2021, 86, 153515.
- For reports on the synthesis of 2(- difluoromethyl)- benzoheteroles via cyclization, see:(a)Ge, F.; Wang, Z.; Wan, W.; Hao, J. Synlett 2007, 447–450.(b)Wang, Z.-x.; Zhang, T.-f.; Ma, Q.-w.; Ni, W.-g. Synthesis 2014, 46, 3309– 3314.
- (a)Ishibashi, Y.; Fujita, T.; Ichikawa, J. Org. Lett. 2022, 24, 9306–9310.(b)Ishibashi, Y. PhD thesis, University of Tsukuba, Tsukuba, Japan, 2023.