AGC Research Report 73(2023)
Improvement of productivity and quality of adeno-associated viruses for in vivo gene therapy by addition of alcohol
アルコールの添加によるin vivo 遺伝子治療用アデノ随伴ウイルスの生産性及び品質の向上
椎名俊介* **
Shunsuke Shiina
*AGC株式会社横浜テクニカルセンター(shunsuke.shiina@agc.com)
**AGC Biologics Inc.(shunsuke.shiina@agc.com)
遺伝子治療用医薬品には、高い治療効果と効果の持続性から次世代の医薬品としての期待が高く、世界中で開発や製品化が進んでいる。中でも遺伝子組換えアデノ随伴ウイルス(recombinant Adeno-Associated Virus: rAAV)は、in vivo遺伝子治療用医薬品として最も開発が進められているウイルスベクターの一つである。しかしながら、多くのrAAVベクターの生産方法として用いられる、Human Embryonic Kidney 293(HEK293)細胞を用いたrAAVベクターの一過性発現は生産性が低く、更には生産されるrAAV粒子内のrAAVゲノムの断片化や、rAAVゲノムを持たない不純物となる粒子が多く出来る事が課題となっている。
本研究では、上記の課題を解決するため、HEK293の浮遊培養でrAAVセロタイプ2(rAAV2)ベクターを生産する際のエンハンサーを検討した。その結果、一定の濃度範囲となるようにエタノールを添加することで、rAAVベクター生産中のHEK293細胞の生存率や、rAAV2ベクターの生産性が向上する事、また、rAAV2粒子内にパッケージングされたゲノムの断片化を低減できることを認めた。更に、HEK293細胞内のプロテオーム解析によりパスウェイを調べた結果、上記の効果を裏付けるパスウェイの変化を認めた。これらの結果から、エタノール添加は、安全かつ安価に rAAVベクターの生産性や、品質を向上させることの出来る手段となる可能性が示唆された。
Gene therapy products are highly anticipated as the next generation of biologics due to their therapeutic efficacy and long-lasting effect. The development and production of these therapies are rapidly progressing worldwide. Among these, the recombinant Adeno- Associated Virus(rAAV)has emerged as a promising viral vector for in vivo gene therapy. However, challenges persist with the current production method, particularly the transient expression of rAAV vectors in Human Embryonic Kidney 293(HEK293)cells, which is the most popular technique. This process is inefficient as the rAAV genome often becomes fragmented during packaging into rAAV particles. Many particles fail to package the rAAV genome at all, resulting in incomplete particles that contaminate the final product. This represents a significant issue in the production of rAAV vectors.
In the present study, we explored potential enhancements to the production of rAAV serotype 2(rAAV2)using a HEK293 suspension culture. We discovered that adding ethanol within a specific concentration range improved the viability of producer cells during rAAV2 vector production. Furthermore, the addition of ethanol also enhanced the productivity of rAAV2 vector and the integrity of the packaged genome. To understand the mechanism behind these effects, we conducted a proteome analysis on HEK293 cells. Our findings indicated changes in certain pathways which seemed to be responsible for the improvements seen with the ethanol addition. This leads us to believe that the addition of ethanol may provide a safe and cost-effective method to enhance the productivity and quality of rAAV vectors.
1. 緒言
遺伝子治療は、本来あるべき細胞の機能を回復する為に特定の遺伝子を患者の細胞に導入する治療法であり、高い治療効果と持続性から次世代の医療としての期待は高く、2023年2月時点で世界では26の遺伝子治療用医薬品が承認されており、医薬品承認申請中または第3相臨床試験段階にある主な遺伝子治療用医薬品が24以上ある(1)。
ベクター等を用いて治療用遺伝子を患者の細胞に導入するin-vivo遺伝子治療の70%以上でアデノウイルス(AdV)やアデノ随伴ウイルス(AAV)、レンチウイルス(LV)が用いられているが(2)、中でも遺伝子組み換えアデノ随伴ウイルス(recombinant Adeno-Associated Virus; rAAV)は、導入される遺伝子が患者のゲノムに組み込まれないことや、長期に渡り患者の細胞内に留まり目的のタンパク質を発現すること、免疫原性やヒトに対する病原性が低い等の、安全性や安定性の理由から最も開発が進んでいる。2023年2月時点で世界中で6種類のrAAVベクターが医薬品承認を受けている。
rAAVベクターの生産方法として最も一般的な方法は、培養したHuman Embryonic Kidney 293(HEK 293)細胞に、rAAVベクターの生産に必要な3種類のプラスミドDNAをトランスフェクションし、一過性発現させる方法である。しかしながら、高密度細胞条件ではトランスフェクション効率が低下することから、細胞数を増やして培養液あたりの生産性を上げることが難しい。rAAVのセロタイプ(血清型)や分析方法により差はあるものの、HEK293由来細胞を用いた一般的なrAAVベクターの生産性は、1.8 × 103~2.1 × 105 vector genome/cell(vg/cell)であり(3)、全身投与が必要な疾患の需要に対しては十分な生産性が得られない(4)。更に、HEK293細胞でrAAVベクターが生産される際、治療用のrAAVゲノムの完全体を含む rAAV粒子の割合は、30%未満であると言われており(5)、rAAVゲノムが断片化している、またはrAAVゲノムを持たない、不純物となるrAAV粒子は精製工程での多大な負荷となっている。以上のことから、rAAVベクターの生産においては、生産細胞での生産性を上げると同時に、rAAVゲノムの完全体を持つrAAV粒子の割合を増やすことが大きな課題である。
rAAVベクターの生産性やゲノムのパッケージング効率を向上させるために、細胞密度や、トランスフェクション試薬の量、3種類のプラスミドDNAの量や比率の最適化に関する先行研究はあるが、これらの条件は生産細胞やrAAVのセロタイプに依って変化する(6, 7)。また、細胞を用いた遺伝子組換えタンパク質の生産やウイルス様粒子の生産で、細胞の増殖制御や、遺伝子発現制御の作用を持ち、目的物質の生産性を向上させるエンハンサーとなる物質の添加に関する先行研究(8, 9)はあるが、HEK293細胞を用いたrAAVベクターの生産に有効なエンハンサーの報告はこれまでになかった。
また、近年の分析技術の進化、大量のデータ蓄積やArtificial Intelligence(AI)技術の発展に伴い、細胞内のタンパク質や発現遺伝子、代謝物質などのデータに基づくマルチオミクス解析が進んでいる。HEK293細胞に関しても、遺伝子組換えタンパク質生産時や、複数のHEK293由来細胞の特徴を明らかにするために、マルチオミクス解析を用いた先行研究(10,11)はあるが、いずれもrAAVベクターの生産性や品質の向上に結びつく物ではなかった。
このような背景のもと、筆者らはrAAVベクターの中でも遺伝子治療用医薬品としての実用化例のある、HEK293細胞の浮遊培養によるrAAV2ベクターの生産において、生産性や品質の向上に有効なエンハンサーの探索を行い、エタノールがrAAV2ベクターの生産性向上と、rAAV2粒子内のrAAVゲノムの完全性を向上させる効果があることを見出した。また、エタノールを添加した際の、HEK293細胞内のプロテオームデータから、rAAV2ベクターの生産に重要な細胞内タンパク質の変動や、パスウェイの変化を解析した。
2. 実験方法
2.1. HEK293細胞によるrAAV2ベクターの生産
本研究では、生産細胞として、無血清培地で浮遊培養が可能なHEK293由来の細胞(Expi 293F細胞、Thermo Fisher Scientific)を、培地にはHEK293細胞用の無血清培地(HE400AZ、Gmep)を用いた。フィルターキャップ付き三角フラスコを用いてHEK293細胞を2.5~3.5 × 106 cells/mLとなるまで振盪培養(37 ± 2℃、8% CO2、125 ± 5 rpm)した後、遠心分離により細胞を回収した。回収した細胞6 × 107 cellsを27mLの新鮮培地に懸濁し、125mLフィルターキャップ付き三角フラスコに移した後、トランスフェクションまで3~4時間培養した。
rAAV2ベクター生産用のプラスミドDNAには、(i)AAV2のRepタンパク質及びCapタンパク質をコードするプラスミドDNA(pRC-mi342、タカラバイオ)、(ⅱ)アデノウイルス5型由来のヘルパータンパク質をコードするプラスミドDNA(pHelper、タカラバイオ)、(ⅲ)Gene of Interest(GOI)として Green Fluorescence Protein(GFP)発現遺伝子を組み込んだrAAVゲノムをコードするプラスミドDNA(pAAV-GFP, Cell Biolabs Inc.)の3種類を用いた。トランスフェクションするフラスコ1本辺りそれぞれ(ⅰ):1.0μg、(ⅱ):0.5μg、(ⅲ):0.5μg、及びトランスフェクション試薬(FectoVIR-AAV、Poly plus)4μLをDMEM培地に懸濁し3mLとして、プラスミドDNAとトランスフェクション試薬のコンプレックスを調製した。上述の手順で細胞密度を調整したフラスコに、コンプレックス3mLを添加し(培養液量:30mL/フラスコ)、7 0~74時間振盪培養して rAAV2ベクターを生産した。
2.2. エンハンサー溶液の調製及び添加
本研究では、遺伝子組換えタンパク質や、ウイルス様粒子の生産性向上に効果があることが知られている(8, 9)カフェイン、及びバルプロ酸(VPA)の効果を検討することとした。また、VPAの溶媒として用いたエタノール単独での効果を検討した。
カフェイン溶液は100mMとなるように精製水に溶解して調製した。VPA溶液は500mMとなるようにエタノールに溶解した。それぞれの溶液、及びエタノールを孔径0.22μmのフィルターで濾過してエンハンサー溶液とした。トランスフェクション約4時間後のフラスコに、それぞれ目的のエンハンサー濃度となるように溶液を添加し、トランスフェクションから70~74時間後まで培養を行い rAAV2ベクターを生産した。
2.3. rAAV2ベクター生産性及びゲノム完全性の評価
rAAV2ベクター生産中及び生産終了時の培養液から、遠心分離により細胞ペレットを回収し、AAV Pro Titration Kit(タカラバイオ)を用いてrAAV2粒子全体を抽出した。rAAV2抽出液にDNaseを加えてrAAV2粒子外のDNAを消化した後、EDTAで DNaseを不活化し、DNeasy Blood & Tissue kit(Qiagen)を用いて、rAAVゲノム抽出液を調製した。
rAAV2ベクターの生産性及びゲノム完全性の評価には、Droplet Digital PCR(ddPCR)を用いた。rAAVゲノム上のInverted Terminal Repeat(ITR)コード領域をターゲットとしたFAM標識プライマーと、GOIとして組み込まれたGFPコード領域をターゲットとしたHEX標識プライマーを用い、ITRコード領域のみ(ITR+, GPF-)、またはGFPコード領域のみ(ITR-, GFP+)のrAAVゲノム断片と、ITRコード領域、GFPコード領域の両方を持つ完全体(ITR+, GFP+)のrAAVゲノムとを区別した。本研究では、rAAV2ベクターの生産性はITR+, GFP+のrAAVゲノムの定量値(ゲノムタイター)から評価した。また、ゲノム完全性は、rAAVゲノム断片を含む検出された全てのrAAVゲノムのうち、rAAVゲノム完全体の割合により評価した。
2.4. rAAV2ベクターの細胞感染性評価
rAAV2ベクターの細胞感染性の評価には、HeLa細胞を使用した。24ウェルプレートにHeLa細胞を1 × 104 cells/wellずつ播種した2日後に、不完全なrAAVゲノムも含むITRコード領域をターゲットとした ddPCRのゲノムタイターにもとづいて、30,000または10,000vg/well分のrAAV2ベクター抽出液を細胞に添加し培養した。3日後に細胞を回収し、フローサイトメトリーにより、rAAV2ベクターの感染によってGFPを発現した細胞数を測定した。得られた測定値から、各条件で生産したrAAV2ベクター抽出液辺りの細胞感染性を評価した。
2.5. Liquid chromatography-mass spectrometry(LC/MS)による細胞内プロテオーム分析とパスウェイ解析
トランスフェクション4時間後(エンハンサー添加直後)、約48時間、約72時間後の培養液から遠心分離で回収した細胞から抽出した20μg分のタンパク質を精製後、トリプシンで消化してペプチド溶液を得た。得られたペプチド溶液を脱塩、濃縮後に乾燥してプロテオーム解析用のペプチドサンプルとした。
LC/MSシステムは、EASY-nLC 1200(Thermo Fisher Scientific)、及びOrbitrap Eclipse Tribrid mass spectrometer(Thermo Fisher Scientific)を用いた。また、カラムにはNANO HPLC CAPILLA RY COLUMN(75μm i.d × 120mm、日京テクノス)を用いた。ペプチドサンプルをLC/MSに供して得られたデータを、Proteome Discover 2.4(Thermo Fisher Scientific)を用いて解析した。abundanceの標準化には全ペプチド量を用い、標準化後のabun dance値を比較した時に、調整済みp値が0.05未満であり、コントロール条件に対するfold changeが2より大きい、または0.5未満の場合、それぞれのタンパク質の発現が増加あるいは減少したと判断した。
得られたプロテオームデータから、エンハンサーを添加した際にコントロール条件と比べて発現量の変化が大きかったタンパク質データを元に、rAAV2ベクター生産中のHEK293細胞内で変化したパスウェイを解析した。バスウェイの解析には、Ingenuity Path way Analysis(IPA, Qiagen)を用いた。コントロールに対するfold changeが2以上または0.5以下のものをそれぞれ増加または減少とした。解析には、IPAのデータバージョン70750971(2021-10-23)を用いた。
3. 実験結果および考察
3.1. エンハンサーの予察検討
HEK293細胞を用いたrAAV2ベクターの生産では、殆どのrAAV2が細胞内に生産されることが知られており(12)、本研究において何れの条件においても、90%以上のrAAV2がHEK293細胞内に生産されたことから、本報告ではHEK293細胞内に生産された rAAV2ベクターについて述べる。
rAAV2生産時に各エンハンサーを添加した際の、トランスフェクション72時間後のHEK293細胞内から抽出したrAAVゲノムタイターのコントロール条件との相対値をFig.1(a)に、rAAVベクター内にパッケージングされたrAAVゲノムの完全体の割合をFig.1(b)に示す。
カフェインを添加した条件では、ゲノムタイター、ゲノムの完全性の何れもコントロールよりも低下しており、rAAV2ベクター生産のエンハンサーとしての効果が期待できないと考えられた。一方、1.5mM程度の低濃度のVPAを添加した際にゲノムタイターはコントロールと同等以上となる傾向が見られた。また、VPAを添加した条件では何れもゲノムの完全性が向上する傾向が見られた。更には、エタノールのみ添加した条件では、ゲノムタイター、ゲノムの完全性の何れも向上する傾向が見られた。このことから、1.5mMのVPA添加と、エタノールの添加に絞り、適切なエンハンサーと添加量の検討を行った。
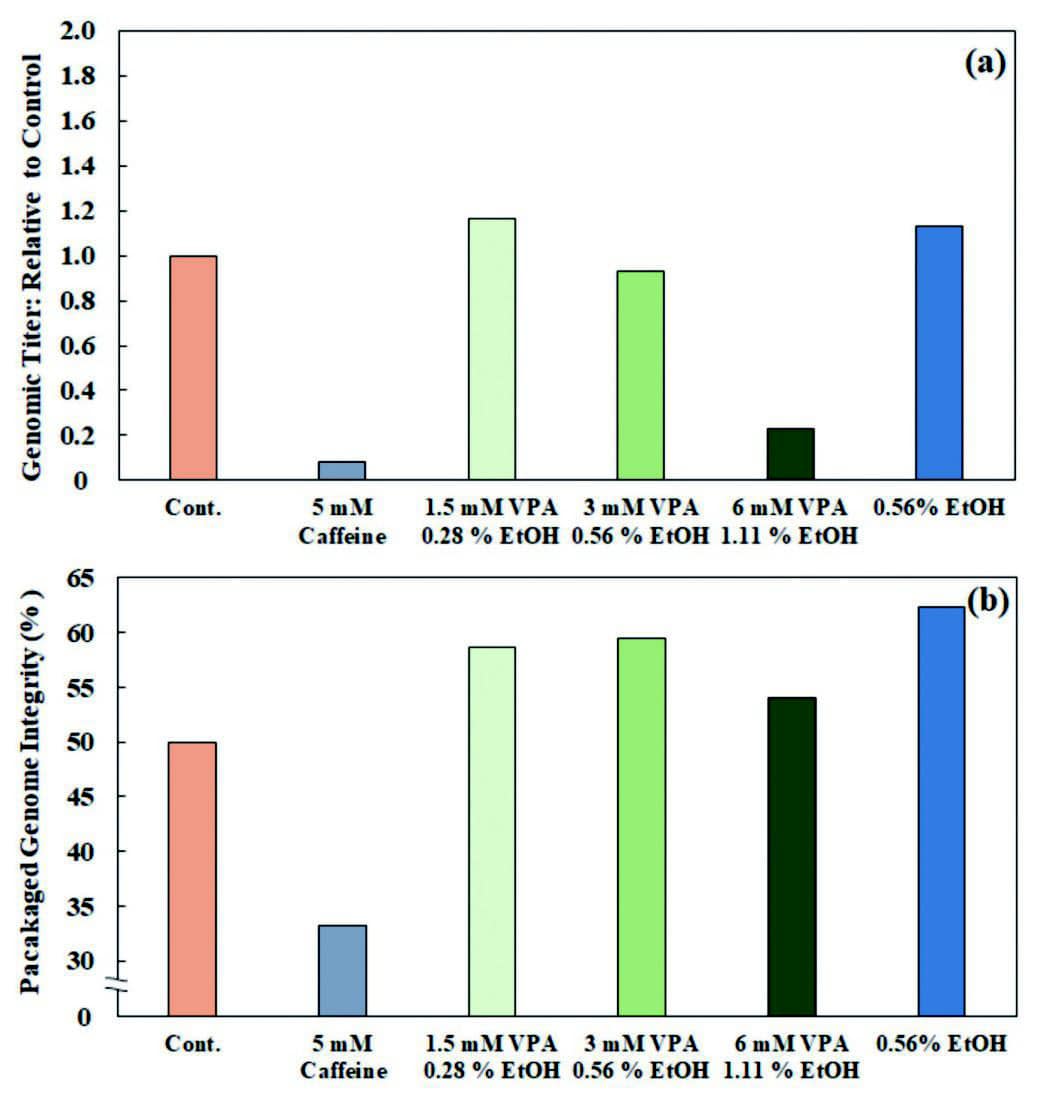 Fig.1 Preliminary Result of Enhancer Candidates on rAAV2 production using HEK293 cells.,
Fig.1 Preliminary Result of Enhancer Candidates on rAAV2 production using HEK293 cells.,(a):Genomic titer of each condition relative to control.,
(b):Percentage of genome integrity packaged into rAAV2 vectors.
3.2. VPA及びエタノール添加がrAAV2生産性及びゲノム完全性に与える影響
エンハンサーの予察検討の結果から、1.5mM VPA + 0.56%(v/v)エタノール(エタノールはVPAの溶媒として使用)及び0.56%エタノールを添加した際の、rAAV2ベクターの生産性及びゲノム完全性に与える影響を検討した。
各条件におけるトランスフェクション後のHEK293細胞のViable Cell Density(VCD)及び生存率の推移をFig.2(a)に、H EK 293細胞内に生産されたrAAV2ベクターのゲノムタイターのコントロールに対する相対値、及びゲノムの完全性割合をそれぞれFig.2(b)及びFig.2(c)に示す。
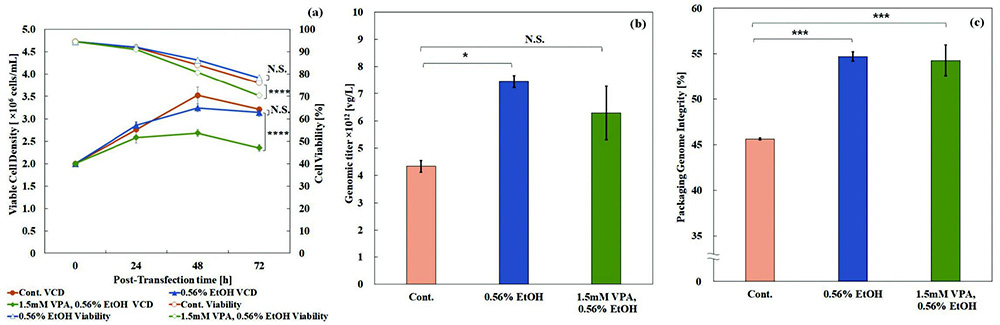 Fig.2 Culture Profile of HEK293 cells, Genomic titer and Packaged Genome Integrity When Enhancer added.
Fig.2 Culture Profile of HEK293 cells, Genomic titer and Packaged Genome Integrity When Enhancer added.(a):Viable cell density and Cell viability of producer cells during rAAV2 production.,
(b):Genomic titer on each conditions.,
(c):Percentage of genome integrity packaged into rAAV2 vectors on each conditions.
Statistical analyses were performed using Dunnett’s test and asterisks indicate the statistical differences between the control and each condition. * = p < 0.05, *** = p < 0.005, **** = p < 0.001, N.S. = not significant
参考文献(13)より改変転載
エタノールと共にV PAを添加した条件では、rAAV2ベクター生産中の細胞の増殖が抑制され、コントロール条件と比べて生存率も明らかに低下した。一方で、エタノールのみを加えた条件では、rAAV2ベクター生産中の細胞の増殖や生存率には影響を与えなかった。そして、エタノールのみを添加した条件では、rAAV2ベクターの生産性及びゲノムの完全性が有意に向上したのに対し、VPAを添加した条件では rAAV2ベクターの生産性に対して試験間でのバラツキが出やすく、有意な効果が認められなかった。しかし、VPAと共にエタノールが添加されている条件では、エタノール単独添加と同様に、ゲノムの完全性の向上が明らかであった。
以上のことから、HEK293細胞を用いたrAAV2の生産において、エタノールの添加がrAAV2ベクター生産性及びrAAV2ベクター内にパッケージングされたゲノムの完全性向上に効果があることを見出した。
なお、筆者らはエタノール添加の効果について、浮 遊HEK293細胞を用いた異なるセロタイプのrAAVベクターの生産においても、同様の効果があることや、別のアルコール類の幾つかに同様の効果があることを確認しており(データ未掲載)、アルコール類の添加によってrAAVベクター等の生産に関係する効果を HEK293細胞に与えていると考えられる。
3.3. ゲノムの完全性がrAAV2ベクターの細胞感染性に与える影響
不完全なrAAV2ゲノムを含むITR領域をターゲットとしたddPCRのゲノムタイター値から、それぞれの条件で得られたrAAV2ベクター抽出液の濃度を揃えた時の、HeLa細胞への感染力価をTable 1に示す。エタノール単独、またはエタノールに溶解したVPA溶液を添加することで、パッケージングされた rAAV2ゲノムの完全性率が向上したrAAV2ベクターは、コントロール条件と比べてHeLa細胞への感染力が明らかに向上しており、パッケージングされた rAAV2ゲノムの完全性率の向上は、ウイルスベクターとして重要な機能である細胞感染力価の向上に効果があることが示唆された。
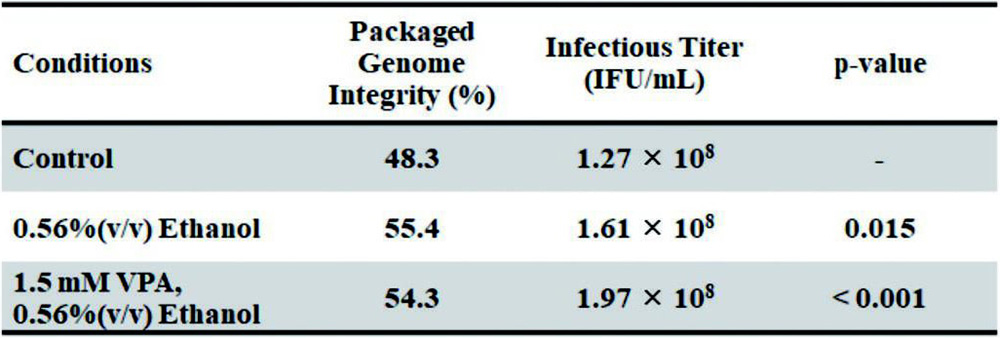 Statistical analyses were performed using Dunnett’s test.
Statistical analyses were performed using Dunnett’s test.参考文献(13)より改変転載
3.4. ゲノムの完全性がrAAV2ベクターの細胞感染性に与える影響
前項までにエタノールがHEK293細胞を用いたrAAV2ベクター生産のエンハンサーとなることを見出したため、最適なエタノール添加濃度の検討を行った。
rAAV2ベクター生産中のHEK293細胞培養液内濃度が0~2.23%(v/v)となるようにエタノールを添加した際の、トランスフェクション約72時間後の細胞の生存率をFig.3(a)に、細胞内に生産されたrAAV2ベクターのゲノムタイターのコントロール条件に対する相対値をFig.3(b)、rAAV2ベクター内のrAAV2ゲノムの完全性をFig.3(c)に示す。
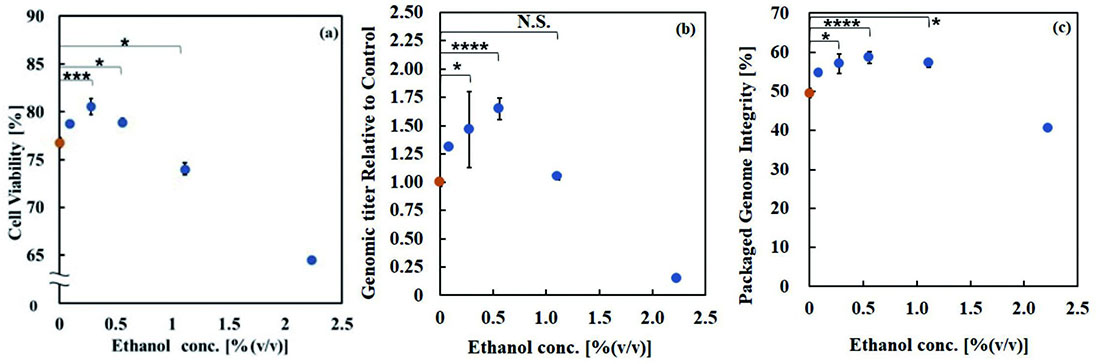 Fig.3 Cell viability, Genomic titer and packaged genome integrity at each ethanol addition concentration.
Fig.3 Cell viability, Genomic titer and packaged genome integrity at each ethanol addition concentration.(a):Cell viability at 72 hours post-transfection.,
(b):Genomic titer of each condition relative to control.,
(c):Percentage of genome integrity packaged into rAAV2 vectors.
Statistical analyses were performed using Dunnett’s test and asterisks indicate the statistical differences between the control and each condition.
* = p < 0.05, *** = p < 0.005, **** = p < 0.001, N.S. = not significant
参考文献(13)より改変転載
トランスフェクション72時間後のVCDの値については、コントロールに対して有意な差は見られなかったが、エタノール濃度が0.28%(v/v)の範囲では高くなる傾向が見られ、1.11%(v/v)以上では、低下する傾向が見られた(データ未掲載)。一方、エタノール濃度0.56%(v/v)以下の範囲ではHEK293細胞の生存率向上の効果が認められた。
rAAV2の生産性に対しては、エタノール濃度0.09~0.56%(v/v)の範囲で、明らかな生産性向上効果を認めた。また、rAAV2ベクター内のゲノムの完全性についても、0.09~1.11%(v/v)の範囲で、明らかな向上効果を認めた。
以上のことから、HEK293細胞を用いたrAAV2ベクターの生産においては、0.6%(v/v)程度のエタノールの添加が有効であることが明らかとなった。
3.5. 細胞内プロテオームに基づくパスウェイ変化の解析
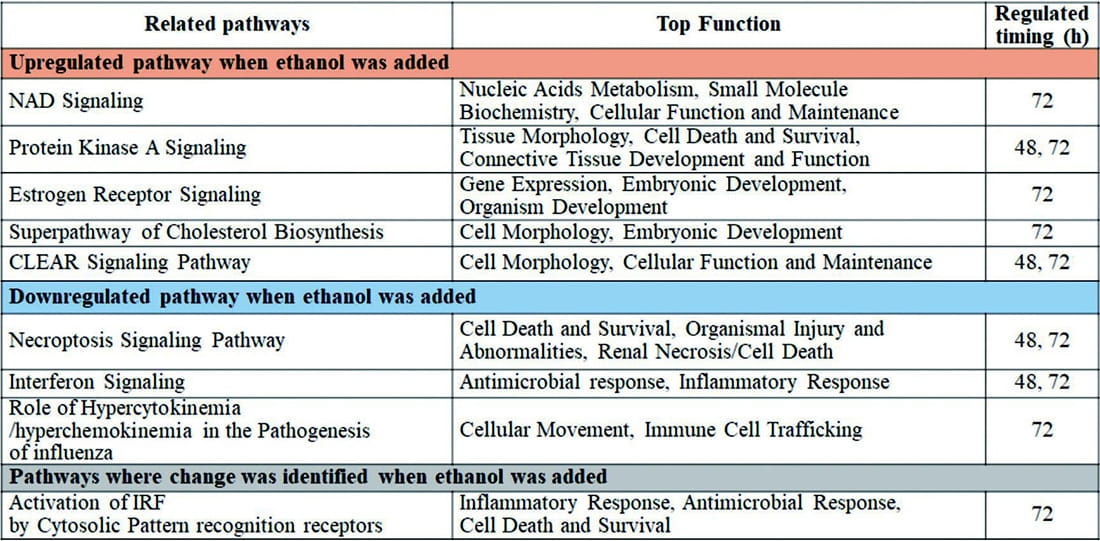
rAAV2生産中のHEK293細胞内のプロテオームデータに基づいて、エタノール単独 [0.56%(v/v)]、またはエタノールに溶解したVPA [エタノール0.56%(v/v), VPA 1.5mM] を添加した時に、コントロール条件と比べて有意に発現量が増加、または低下したタンパク質の数の関係をFig.4(a)~(d)に示す。エタノールを添加した条件では、コントロール条件と比べて、トランスフェクション約48時間後には98種、約72時間後には63種のタンパク質の発現量が増加し、それぞれ67種、40種のタンパク質はVPAと共にエタノールを添加した時にも共通して増加していた。また、エタノールを添加した条件では、コントロール条件と比較して、トランスフェクション48時間後には 88種、72時間後には70種のタンパク質の発現量が減少し、それぞれ34種、29種のタンパク質はVPAと共にエタノールを添加した際にも共通して減少していた。これらのタンパク質の発現量の変化が、rAAV2ベクター生産時のHEK293細胞の生存率や、rAAV2ベクターの生産性、ゲノムの完全性に影響した可能性が考えられたため、発現量が変動したタンパク質と、HEK293細胞のパスウェイの変化の関係を、パスウェイ解析ソフトウェア(IPA)を用いて解析した。解析の結果、エタノールの添加によって、コントロール条件と比べてアップレギュレート、またはダウンレギュレートされていると考えられたパスウェイとそれらの主要な機能をTable 2に示す。rAAV2ベクター生産時にエタノールを添加した時には、細胞間シグナル伝達や、遺伝子発現調節、細胞形態や細胞内維持に関連する経路がアップレギュレートされ、細胞死、免疫、感染反応に関連する経路はダウンレギュレートされたことが示唆された。これらのパスウェイの変化は、エタノールの添加によるrAAV2ベクター生産時のHEK293細胞の生存率や、rAAV2ベクター生産性、ゲノムの完全性向上を裏付ける結果であった
これらの結果から、今後、エタノールの添加によって変動し、rAAV2ベクターの生産に影響を与えたことが示唆されたタンパク質をターゲットとして細胞の改変をすることで、より生産性の高い細胞を作ること等への応用も期待される
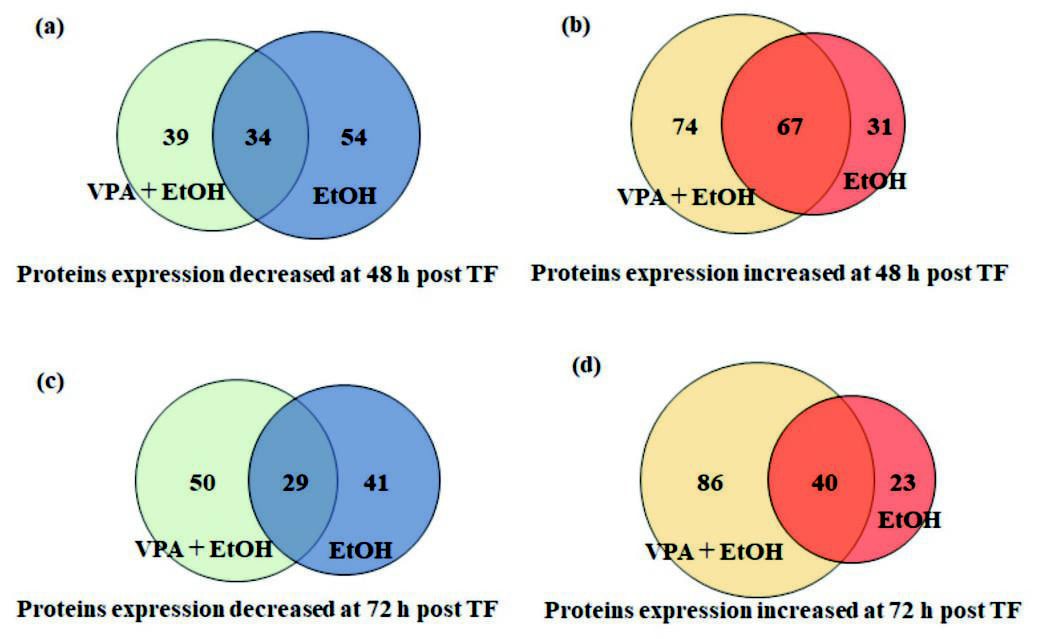 Fig.4 Number of proteins with significantly changed expression levels in HEK293 cells when ethanol only or ethanol and VPA were added during rAAV2 produ ction.
Fig.4 Number of proteins with significantly changed expression levels in HEK293 cells when ethanol only or ethanol and VPA were added during rAAV2 produ ction.参考文献(13)より改変転載
 参考文献(13)より改変転載
参考文献(13)より改変転載4. 総括
rAAVベクターは世界中で多くの開発や製品化が進められ、次世代のバイオ医薬品としての期待が大きい一方で、生産性や品質の向上方法の開発が発達途上であり、医薬品用途のrAAVベクター生産の中で、安全かつ安定的に効果のある技術の開発は急務である。本研究では、スケールアップ性の高い浮遊HEK293細胞を用いたrAAV2ベクター生産系で、rAAV2ベクターの生産性や品質向上に効果のあるエンハンサーの探索を行った。その中で、一定の濃度範囲内でエタノールを添加すると、rAAV2ベクター生産中のHEK293細胞の生存率、rAAV2ベクターの生産量、rAAV2ベクター内のゲノムの完全性が向上することを見出した。
また、rAAV2生産時のHEK293細胞内のプロテオ ーム解析から、エタノールの添加によってHEK293細胞の生存率や、rAAV2ベクターの生産量向上を裏付けるパスウェイの変化を確認した。これらのパスウェイの変化に影響したタンパク質は、rAAVベクターの生産性向上を目的とした生産細胞の開発の中でも、遺伝子改変等による発現量制御の対象として期待される。エタノールは、医療現場や医薬品の生産プロセスで 頻繁に使われる、安価で安全な薬品であり、工業的な rAAV2ベクターの生産においても使いやすい原料である。そのエタノールの添加によって、rAAVベクターの生産性と品質を向上する事ができることが示唆されたことから、今後のウイルスベクター生産において実用化が期待される。
5. 謝辞
本研究結果を論文するにあたり、ご指導をいただきました筑波大学大学院理工情報生命学術院生命地球科学研究群、青柳秀紀教授に感謝いたします。
参考文献
- 国立医薬品食品衛生研究所 遺伝子医薬部ホームページ https://www.nihs.go.jp/mtgt/, 2023年2月
- Alhakamy, A., Curiel, D. and Berkland, C.: The era of gene therapy: from preclinical development to clinical application, Drug Discov. Today, 26, 1602-1619(2021).
- Robert, M., Chahal, P., Audy, A., Kamen, A., Gilbert, R. and Gaillet, B.: Manufacturing of recombinant adeno- associated viruses using mammalian expression platforms, Biotechnol. J., 12, 1600193(2017).
- Dobrowsky, T., Gianni, D., Pieracci, J. and Suh, J.: AAV manufacturing for clinical use: insights on current challenges from the upstream process perspective, Curr. Opin. Biomed. Eng., 20, 100353(2021).
- Joiner, J., Huang, Z., McHugh, K., Stebbins, M., Aron, K., Borys, M. and Khetan, A.: Process modeling of recom binant adeno-associated virus production in HEK293 cells, Current Opinion in Chemical Engineering, 36, 100823(2022).
- Huang, X., Hartley, A., Yin, Y., Herskowitz, J. H., Lah, J. J. and Ressler, K. J.: AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J. Virological Methods, 193, 270-277(2013).
- Zhao, H., Lee, K., Daris, M., Lin, Y., Wolfe, T., Sheng, J., Plewa, C., Wang, S. and Meisen, W. H.: Creation of a high- yield AAV vector production platform in suspension cells using a design-of-experiment approach.mol. Ther. Methods & Clin. Dev., 18, 312-320(2020).
- Cervera, L., Fuenmayor, J., González-Domínguez, I., Gutiérrez-Granados, S., Segura, M. M. and Gòdia, F.: Selection and optimization of transfection enhancer additives for increased virus-like particle production in HEK293 suspension cell cultures. Appl. Microbiol. Biotechnol., 99, 9935-9949(2015).
- Backliwal, G., Hildinger, M., Kuettel, I., Delegrange, F., Hacker, D. L. and Wurm, F. M.: Valproic acid: A viable alternative to sodium butyrate for enhancing protein expression in mammalian cell cultures. Biotechnol. Bioeng., 101, 182-189(2008).
- Dietmair, S., Hodson, M. P., Quek, L., Timmins, N. E., Gray, P. and Nielsen, L. K.: A multi-omics analysis of recombinant protein production in Hek293 cells. PLoS One, 7, e43394(2012).
- Malm, M., Saghaleyni, R., Lundqvist, M., Giudici, M., Chotteau, V., Field, R., Varley, P. G., Hatton, D., Grassi, L., Svensson, T., Nielsen, J. and Rockberg, J.: Evolution from adherent to suspension: systems biology of HEK293 cell line development. Sci. Rep., 10, 18996(2020).
- Vandenberghe, H. L., Xiao, R., Lock, M., Lin, J., Korn, M. and Wilson, M. J.: Efficient serotype-dependent release of functional vector into the culture medium during adeno- associated virus manufacturing. Hum. Gene. Ther., 21, 1251-1257(2010)
- Shiina, S., Nagao, N., Hasegawa, J., Sato, T., Mori, C., Ohtaki, K., Kubodera, K., Yamashita, Y., Tanabe, K., Kawano, Y. and Aoyagi, H.: Effect of alcohol on productivity and quality of adeno-associated virus 2 in HEK293 cells, J. Biosci. Bioengi., 134, 338-347(2022).