AGC Research Report 73(2023)
Chemical valence speciation analyses of multivalent elements in glass(1)Determination of sulfide sulfur and sulfate sulfur
ガラス中の多価元素の価数別化学分析方法の開発(1)硫化物硫黄と硫酸塩硫黄の定量
西條佳孝*
Yoshitaka Saijo
*AGC株式会社 先端基盤研究所(yoshitaka.saijo@agc.com)
ガラスに添加される多価元素は、その総濃度だけではなく、価数別の濃度がガラスの特性に影響を与える。したがって、所望のガラス特性を達成するためにはガラス中多価元素の各価数の濃度を調整することが必要であり、それに伴って多価元素の価数別の濃度を定量する信頼性の高い方法が必要となる。また、それらの方法は実際の製造現場でガラスの特性を最適化するために、大量生産の現場で実行できる必要がある。ここでは、ソーダライムシリケートガラス中の泡欠点の数や色味に影響を与える、ガラス中の硫化物硫黄と硫酸塩硫黄を一般的に使用されている装置で定量する新しい化学分析方法を開発し、検証した。この方法では、硫化物硫黄を揮散分離法により硫酸塩硫黄と分離した後、残留した硫酸塩硫黄をさらにガラス成分と分離し、それぞれICP発光分光法にて定量する。本方法を2つのガラス認証物質に適用し、硫化物硫黄および硫酸塩硫黄の和として計算される全硫黄濃度が各認証値の範囲内であること、さらにこの方法で得られた2つのガラス認証物質の硫黄の平均価数は、WD-XRFで得られたものとよく一致することを確かめた。
Multivalent elements are incorporated as trace elements into glass to fine-tune its properties. The overall concentration of these multivalent elements, as well as the concentration of each element's valence, significantly impacts the glass properties. As such, it is crucial to accurately determine the concentration of each valence in these multivalent elements to successfully adjust the properties of the glass. Dependable methods to achieve this are necessary and should be feasible at mass-production sites to enhance the properties of the end product. These methods must also be consistently executable using standard laboratory equipment and apparatus. In this paper, we introduce and illustrate a new methodology for determining the concentration of sulfide and sulfate in glass. These compounds influence the quantity of bubble defects in the glass and its color. Our method involves separating sulfide from sulfate using a volatilization separation technique. Subsequently, the remaining sulfate is separated from the rest of the glass component. After separation, the quantities of sulfide and sulfate are measured independently using inductively coupled plasma atomic emission spectroscopy. To verify our method's effectiveness, we applied it to two glass reference materials. The total sulfur concentration, calculated as the sum of sulfide and sulfate, fell within the certified value range for each material. Furthermore, the average valences of sulfur, calculated from the sulfide and sulfate quantities, were closely aligned with the average valences of sulfur determined via wavelength-dispersive X-ray fluorescence spectrometric analysis.
1. 緒言
ガラスは幅広い組成、物性を持ち、様々な産業分野で使用される汎用性の高い材料である。また、新たな用途に向けて、日々新しいガラス組成が開発されている。ガラスは、その主成分に加えて、微量成分が透明度[1]、色[2]、フォトルミネッセンス[3]、結晶化[4]、そして製造特性[5–7]など様々な特性に影響を与える。
ガラスに微量成分として多価元素が添加されることがある。多価元素は上記のガラス特性に影響し、さらに特性への影響はその多価元素の各価数によって異なる。したがって、実際のガラス製造において所望のガラス特性を達成するためには、多価元素の価数別の濃度を信頼性の高い方法で定量し調整する必要がある。その定量方法には、原子価選択性、定量性、また添加される多価元素の濃度が低いため高感度が必要とされる。さらに、実際の製造現場でガラスの特性を最適化するために、これらの方法は大量生産の現場で実行できる必要がある。よって実験室で一般的に使用される機器と装置を使用して日常的に実行できる、ガラス中多価元素の価数別の濃度の定量方法が求められる。
一般的なソーダライムシリケートガラスの製造においては、多価元素の一つである硫黄が、硫酸ナトリウム(Na2SO4)の形で添加される。これは清澄剤[8–10]およびアンバー発色剤[11–13]として機能する。清澄とはガラスの脱泡のことである。Na2SO4による清澄のメカニズムは、Na2SO4の分解によるSO2ガスの発生により泡のサイズを増大させ、浮上脱泡させることによる。また、Na2SO4は酸化鉄や還元剤とともに添加されることで、ガラスに琥珀色を与える(アンバー発色)。これは、Fe3+ – S2- – アルカリ金属イオンによる発色団由来と考えられている[11,13]。このようにガラスに添加された硫黄は酸化還元反応を起こし、冷却後のガラス中にはS2-およびS6+の形で残存すると言われている[14,15]。本論文ではガラス中のS2-を硫化物硫黄、S6+を硫酸塩硫黄と呼称することとする。これらの硫黄の価数別の濃度がガラス特性に影響を与えるため、それらの定量方法が求められる。前述したように、その方法は実際の製造現場でガラスの特性を最適化するために、大量生産の現場で実行できる、実験室で一般的に使用される機器と装置を使用して日常的に実行できる方法が望ましい。
ここでガラス中の硫黄の定量分析の先行研究例について述べる。まず、ガラス中の硫黄の総量の分析方法については多数の研究例がある。化学分析方法としては、硫酸バリウムの重量分析[16]、燃焼分離 – 過酸化水素トラップおよびホウ酸ナトリウム滴定法[17]、スズ(II)強リン酸分解 – ヨウ素滴定法[18]、スズ(Ⅱ)強リン酸分解 – イオンクロマトグラフィー法[19]、次亜リン酸 – ヨウ化水素酸還元法[20]、ヨウ化ナトリウム – ヨウ化水素酸 – 次亜リン酸還元法[21]、同位体希釈-フローインジェクション-高分解能誘導結合プラズマ質量分析法[22]、およびフッ化水素酸 – 酸化剤分解 – アルミナカラム分離法[23]があげられる。前処理を必要としない直接分析の例としては、XRF[24,25]や高温燃焼-SO2分離-赤外検出法[26,27]がある。
次に価数分析方法の先行研究例とその長所および短所について述べる。まず化学分析について述べる。Nagashimaらはスズ(II)-強リン酸と強リン酸を用いた火成岩中の全硫黄と硫化物の測定法を報告し[28]、Yaritaらはその方法をガラスに適用した[19]。この方法では、少量のガラスサンプル(約0.1g)を使用し 10μg/gまでの全硫黄および硫化物硫黄が定量可能である。ただし、この方法にはいくつかの欠点もある。1つは、全硫黄と硫化物硫黄を定量するために2回の実験が必要なことである。もう1つの欠点は、還元試薬(スズ(II)強リン酸と強リン酸)を事前に合成する必要があることである。Siegerは、不活性雰囲気下でのフッ化水素酸分解、硫化水素トラップ、AgNO3滴定を組み合わせ、フロート法にて製造されたソーダライムシリケートガラスのTin面の硫酸塩硫黄量を測定することを試みた[29]。しかし、この研究では、再現可能に必要な詳細な手順が十分に示されていない。GuadagninoらはAgNO3を用いた硫化水素トラップおよび原子吸光法により、ガラス中の硫酸塩硫黄の定量を行った[30]。しかし、この方法では全硫黄または硫酸塩硫黄の量は定量されなかった。
次に物理分析について述べる。Satoらは波長分散型(Wavelength-dispersive : WD)XRFを用い、さまざまな硫黄含有物質でS-Kαから硫黄の平均価数を得た[31]。この方法は、化学的な前処理がなく、非破壊で分析できる利点がある。ただし、一結晶による波長分散のため、S-Kαを詳細に分離するには波長分解能が不十分で、硫黄の平均価数のみ得られる。それに対してFaesslerら[32]、およびGohshiら[33]はS-Kαを正確に測定するために、2つの結晶を使用した高分解能型波長分散型蛍光X線分光分析を使用した。この方法では、硫黄含有標準物質を測定し、S-Kαスペクトルをデコンボリューションして、硫黄の価数別の比率を計算している。一方で、この方法にもいくつかの欠点がある。第一に、二結晶型の機構のため、S/N比が低い。ガラス材料に含まれる硫黄の量は少ないため、この方法をガラス材料に適用し、十分なS/N比を得るためには長時間の分析が必要となる。第二に、この方法では、総硫黄濃度を定量するために、総硫黄濃度の決定された標準物質との比較をする、もしくは別の方法での総硫黄濃度を定量することが必要である。
物理分析の一つとして、放射光施設を用いた価数分析手法も報告されている。Parisら[14]、Fleet[34]、およびBacknaesら[15]はX線吸収端近傍スペクトル(X-ray Absorption Near Edge Structure : XANES)を岩石およびガラス材料に適用した。この方法は、硫黄含有標準物質とピーク位置を比較することにより、ガラス材料中の硫黄の原子価状態を推定できる。これらの研究[14,15]は、ガラスには硫化物硫黄(S2-)と硫酸塩硫黄(S6+)が含まれているが、亜硫酸硫黄(S4+)は含まれていないことを示した。一方でこの方法では特にS2-を含有する標準物質では、その価数が同じでも標準物質ごとにピーク位置が変化するという問題がある。これは、XANESが価数情報のみではなく、注目する元素の近傍に位置する原子からの影響の情報を含有するためと考えられている。すなわち、S2-を含有する標準物質ではS2-が直接カチオンと結合しているため、XANESはその影響を含んだ情報となる。Alonso-Moriらはこの点を確認し、シンクロトロン放射光施設を使用したX線発光分光法(X-ray Emission Spectroscopy : XES)によって測定されるS-Kαエネルギーシフトの方が、異なる硫黄種の比率の定量的決定に有利であることを示した[35]。ただしXANESと XESは共に放射光施設を使用する必要があり、日常的な分析には適さないという欠点がある。EPMAによるS-Kαのピークシフトによる硫黄の価数分析は古くより行われている[36]が、ガラスを分析対象とする場合は電子線ビームによるダメージが問題となる[37]。一方、ラマン分光法でもガラス中の硫化物硫黄と硫酸塩硫黄の識別が可能であるが、得られる定量性には課題がある[38]。
このように、実験室で一般的に使用される機器と装置を使用して日常的に実行できるガラス中の硫黄の価数別の定量的な分析方法は知られていない。そのため本研究における目的は、ソーダライムシリケートガラス中の硫酸塩硫黄と硫化物硫黄とを一般的に使用されている装置で定量する新しい方法を開発することである。この研究では、目的に対して最も近い先行研究であるガラス中の硫化物硫黄の定量方法である硫化水素揮散-捕集(トラップ)法[29,30]を基に改善を行う。具体的には、揮散した硫化物硫黄のみならず、残留する硫酸塩硫黄を筆者らの開発した方法にてガラス成分から分離し[23]、それぞれを定量する方法を提案する。この方法では、全硫黄は硫酸塩硫黄と硫化物硫黄の合計として計算可能である。なお、硫化水素揮散-捕集(トラップ)法では、ガラス中の硫化物硫黄(S2-)が酸性の分解溶液中でH2Sとして揮散すること、また、残留した硫酸塩硫黄(S6+)はFeと酸化還元反応を起こさない(式(1)および式(2))ことを活用している。
本研究では、この開発法を2つのガラス標準物質に適用し、方法の妥当性を検証する。総硫黄量については、開発された方法による総硫黄濃度と、ガラス標準物質の総硫黄濃度の認証値を比較する。一方で硫黄の価数別の濃度についての認証値はないことから、2つのガラス標準物質をWD-XRFで測定し、その硫黄の平均価数を算出し、開発された方法により求めた硫黄の平均価数と比較する。ガラス材料には硫酸塩硫黄と硫化物硫黄のみで存在すると言われていることから[14,15]、硫酸塩硫黄と硫化物硫黄の合計が認証値と一致し、平均価数がWD-XRFの結果と一致することを示すことにより、開発された方法の妥当性を検証する[39]。
2. 実験
2.1. 試料
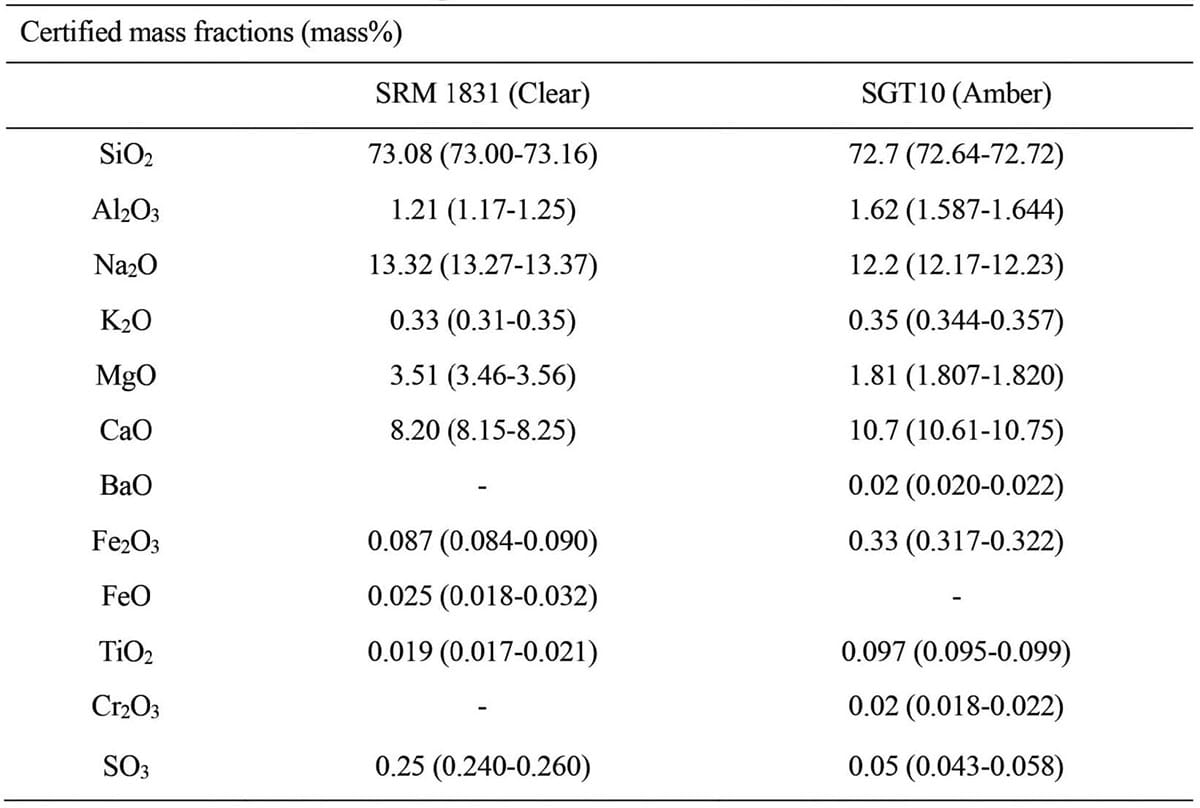
試料としてガラス標準物質NIST(National Instituteof Standards and Technology)製SRM 1831[40]およびSGT(Society of Glass Technology)製SGT10[41]を用いた。なおSRM 1831とSGT10は、それぞれアンバー発色の認められないクリアーガラスと、アンバー発色のあるガラスの代表として選定した。Table 1に試料の組成の認証値を質量分率にて示す。括弧内の値は、95%信頼区間を示す。なお、Sはガラス中ではS2-およびS6+として含有されるが、実際の原子価に関係なく三酸化硫黄(SO3)として記載されている。
2.2. 無機標準物質
WD-XRF測定用の標準物質として、異なる平均価数の硫黄を含む以下の無機標準物質を使用した。
S6+:富士フイルム和光純薬株式会社製 硫酸ストロンチウム(SrSO4)、S4+:関東化学株式会社製 特級ピロ亜硫酸カリウム(K2S2O5)、S2+:関東化学株式会社特級チオ硫酸ナトリウム五水和物(Na2S2O3・5H2O)、S2-:シグマアルドリッチジャパン合同会社製 高純度グレード硫化亜鉛(ZnS)。
2.3. 装置および使用機器
ガラス試料の分解容器として120mLのポリテトラフルオロエチレン(PTFE)製の分解容器、分解時の攪拌のために磁気スターラーと長さ40mm × 直径7mmの撹拌子を使用した。試薬を容器に加えるために、コック付き100mLポリプロピレン(PP)製分液ロートを使用した。30mL PPカップ3つを連結し、トラップとして使用した。Fig.1にこれらの治具の概略を示す。ガラス分解溶液中のフッ化水素酸と塩酸、およびケイ素マトリックスを揮発させるため、100mL PTFE皿を使用した。定容には100mLおよび50mLのメスフラスコを用いた。ガラスマトリックスから硫黄を分離するために、アルミナカラムとしてジーエルサイエンス株式会社製InertSep AL-N Al2O3 500mg/2mLを用いた[23]。溶液中の硫黄の定量のため、日立ハイテク株式会社製ICP発光分光装置SPS5520を用いた。また、試料中の硫黄の平均価数の決定のために、リガク株式会社波長分散型蛍光X線分析装置 ZSX100eを用いて蛍光X線スペクトルを測定した。
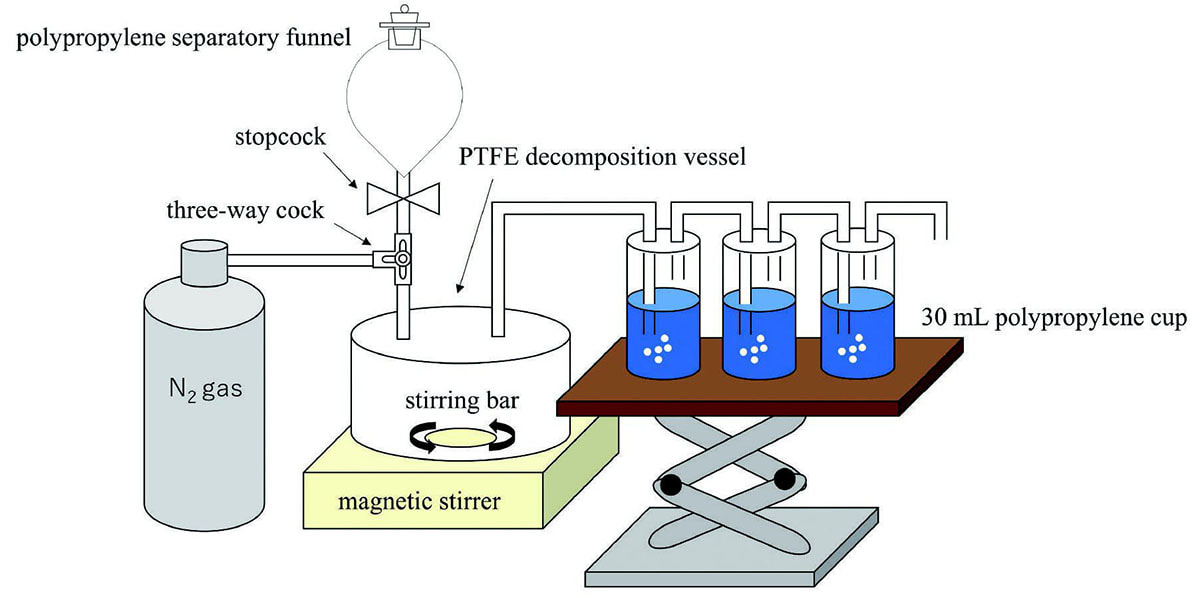 Fig.1 Components of the apparatus for decomposition and a trap. Glass materials are decomposed in the PTFE decomposition vessel with nitrogen flow. Sulfide in glass materials is volatilized as hydrogen sulfide and trapped by a mixture of hydrogen peroxide and sodium hydroxide in polypropylene cups.
Fig.1 Components of the apparatus for decomposition and a trap. Glass materials are decomposed in the PTFE decomposition vessel with nitrogen flow. Sulfide in glass materials is volatilized as hydrogen sulfide and trapped by a mixture of hydrogen peroxide and sodium hydroxide in polypropylene cups.2.4. 試薬
関東化学株式会社製の原子吸光法用のフッ化水素酸(50mass%)、塩酸(36mass%)、過塩素酸(60mass%)およびアンモニア水溶液(25mass%)、特級の過酸化水素水(30mass%)および水酸化ナトリウム、イオンクロマトグラフィー用の硫酸イオン標準溶液(1g SO42-/L)を使用した。超純水は減圧攪拌法にて2時間以上脱気したものを用いた。
2.5. 分析方法
ガラス試料の分解および硫化物硫黄の分離
ガラス試料をメノウ乳鉢とメノウ乳棒で粉砕した。粉砕した試料を電気乾燥機にて110℃で2時間乾燥した。
粉砕および乾燥したガラス試料0.5gをPTFE分解容器に添加し、1mLの脱気した超純水を加えた。12mol/L HF 4mLおよび6mol/L HCl 10mLを分解容器に接続されたPP製分液ロートに加えた。0.3mol/L過酸化水素および0.025mol/L水酸化ナトリウムの混合液10mLを30mL PPカップ3個のそれぞれに加え、それらを連結した。
分解容器内の酸素を追い出すために、窒素ガスを約10mL/sで5分間通じた。ロート内のHF-HCl溶液を分解容器に加えた後、窒素ガスを約10mL/sで通じながら、90分間攪拌することでガラス試料を分解した。
分解が終了した後、30mL PPカップ内の溶液を50mLメスフラスコに移した。各カップと各流路に少量の超純水を加えて洗浄し、同じ50mLメスフラスコに移した後、超純水で定容した。本溶液にはガラス試料に含まれていた硫化物硫黄が含有されるため、S2-溶液と呼称する。
その後PTFE分解容器を開け、分解溶液中の硫黄成分を硫酸に酸化するため、1mol/Lの過酸化水素水1mLを加えた。PTFE分解容器中の分解溶液をPTFE皿に移した。PTFE分解容器に少量の超純水を加えて洗浄し、PTFE皿に移した。PTFE皿に5mLのHClO4を加えた後、PTFE皿をホットプレート上で過塩素酸の煙が観察されるまで加熱した。PTFE皿を放冷した後、PTFE皿内の分解溶液を50mLビーカーに移し、1.8mol/L HClO4にて溶液を約25mLに希釈した。この溶液中の硫酸塩硫黄を、アルミナカラムを使用して分離した[23]。分離後の溶液にはガラス試料に含まれていた硫酸塩硫黄が含有されるため、S6+溶液と呼称する。これらの分析は同条件で3回繰り返し行った。
硫黄の定量および平均硫黄価数の計算
S2-溶液およびS6+溶液に含まれる硫黄の量をICP-AESで定量した。Table 2に、ICP-AESの条件を示す。ガラス試料中の硫化物硫黄濃度および硫酸塩硫黄濃度は、その価数にかかわらず、SO3として計算し、全硫黄濃度はそれらの和とした。ガラス試料中に含まれる硫黄の平均価数は、式(3)に従って計算した。

ブランク試験および定量下限の算出
分解操作、分離操作、定量操作の全行程を通じた空試験を行った。空試験を4回繰り返し行い、空試験値の平均およびその標準偏差(σ)を算出した。定量下限値を空試験値の平均に10σを加えたものとした。
WD-XRFによるS-Kαの測定および硫黄の平均価数の算出
ガラス試料に関して、2種類のガラス試料それぞれ3点を酸化セリウムを用いて鏡面研磨した。
無機標準試料に関して、4種類の標準試料をメノウ乳鉢とメノウ乳棒にて粉砕し、アルミニウムリングを使用しプレスすることでペレットを作製した。
それぞれの試料について、WD-XRFにてS-Kαスペクトルを測定した。X線管はロジウムを用いた。電圧および電流値はそれぞれ30kV、120mAとし、真空条件下で分析した。分光結晶はNaClを用い、検出器はガスフロー比例計数管を用いた。S-Kαスペクトルは、2θとして143.5~146.0度で、1ステップあたりの取り込み時間を1.5sとし、0.020度ごとに測定した。測定後に2θ角度からエネルギー換算した。得られたスペクトルを過去の高分解能型波長分散型蛍光X線分光分析の研究結果[32,33]に基づきS-Kα1およびS-Kα2の2つのガウス曲線にデコンボリューションし、高エネルギー側のピーク(S-Kα1)をスペクトルのピーク位置と定義した。4種類の標準試料に関してはそれぞれ4回測定し、各平均硫黄価数に対するピークエネルギー値の平均と95%信頼区間を算出した。
3. 結果および考察
3.1. 定量下限
S2-溶液およびS6+溶液中の硫黄の定量下限値は、SO3の形でそれぞれ4.9μg/gおよび3.8μg/gであった。本研究における硫化物硫黄の定量下限値は、Nagashimaら[28]やYaritaら[19]の硫化物硫黄の定量下限値である約10μg/gよりも低かった。
3.2. ガラス試料中の硫化物硫黄と硫酸塩硫黄の定量結果
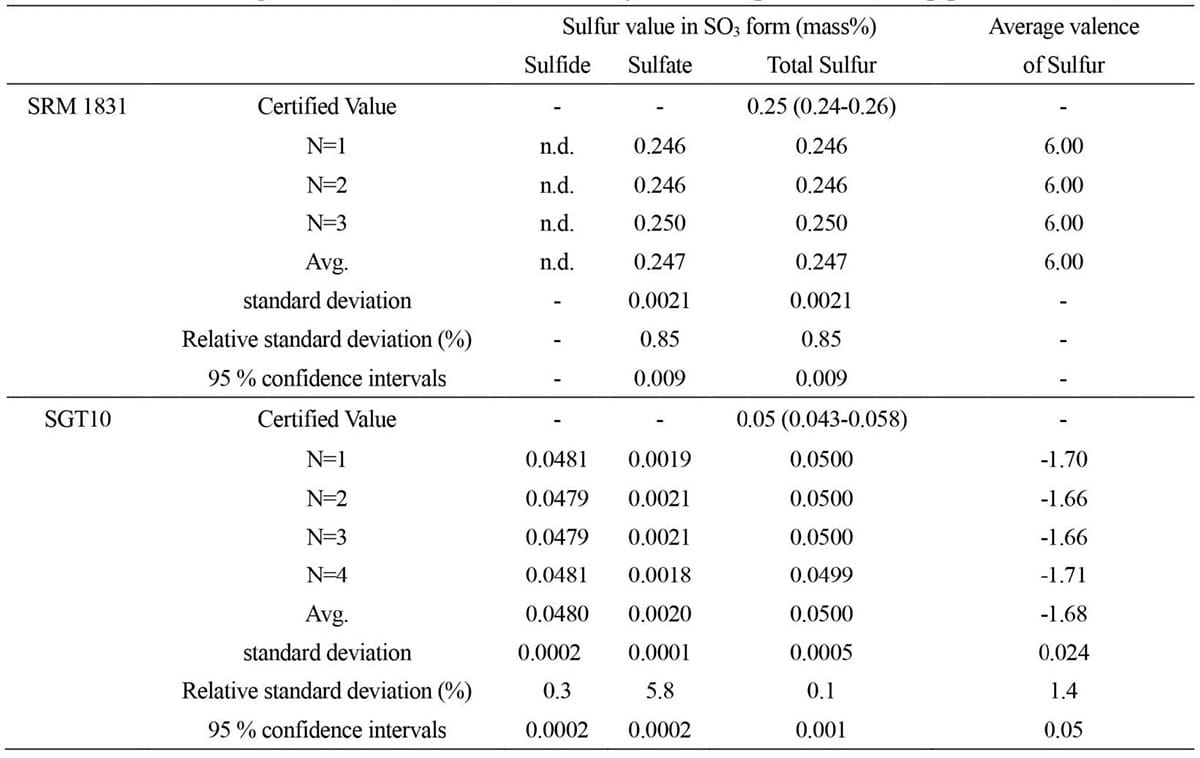
Table 3に2つのガラス試料中の硫化物硫黄と硫酸塩硫黄の分析結果、および硫黄の平均価数を示す。SRM 1831中の硫化物硫黄および硫酸塩硫黄の濃度は、それぞれ検出限界以下および0.247 ± 0.009mass%(平均 ± 95%信頼区間)であった。SGT10中の硫化物硫黄および硫酸塩硫黄の濃度は、それぞれ0.0480 ± 0.0002および0.0200 ± 0.0002mass%であった。硫化物硫黄と硫酸塩硫黄の濃度の和である総硫黄濃度は、それぞれ認証値の範囲内であった。
SRM1831中の硫黄の平均価数は、硫化物硫黄が検出されなかったため、6.00であった。SGT10中の硫黄の平均価数は、-1.68 ± 0.05であった。
3.3. WD-XRFによるガラス試料中の硫黄の価数分析結果
Fig.2にピークトップで正規化した-2から6までの異なる平均価数の硫黄を含む4つの無機標準物質のS-Kαスペクトルを示す。Fig.3に無機標準物質中の硫黄の平均価数とS-Kαピークエネルギーの関係を示す。硫黄の平均価数が増加すると、S-Kαのピークエネルギーが増加し、直線性の良い検量線が得られた。その決定係数は0.993であった。また、4回の測定から計算されたピークエネルギーの標準偏差は、すべて0.02eV未満であった(図中のポイントのサイズはエラーバーよりも大きいためエラーバーは示していない)。この得られた検量線から、SRM1831およびSGT10中の平均硫黄価数を算出したところ、それぞれ5.9 ± 0.1および-1.6 ± 0.2(平均 ± 95%信頼区間)であった。
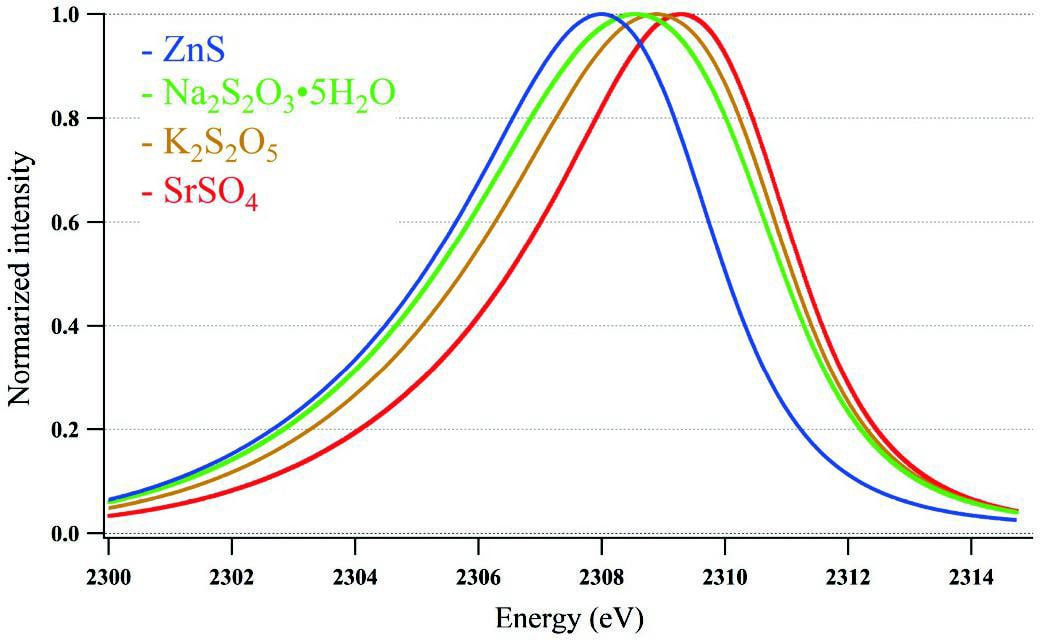 Fig.2 Normalized S-Kα X-ray emission spectra of stron tium sulfate, potassium disulfite, sodium thiosulfate pentahydrate, and zinc sulfide
Fig.2 Normalized S-Kα X-ray emission spectra of stron tium sulfate, potassium disulfite, sodium thiosulfate pentahydrate, and zinc sulfide
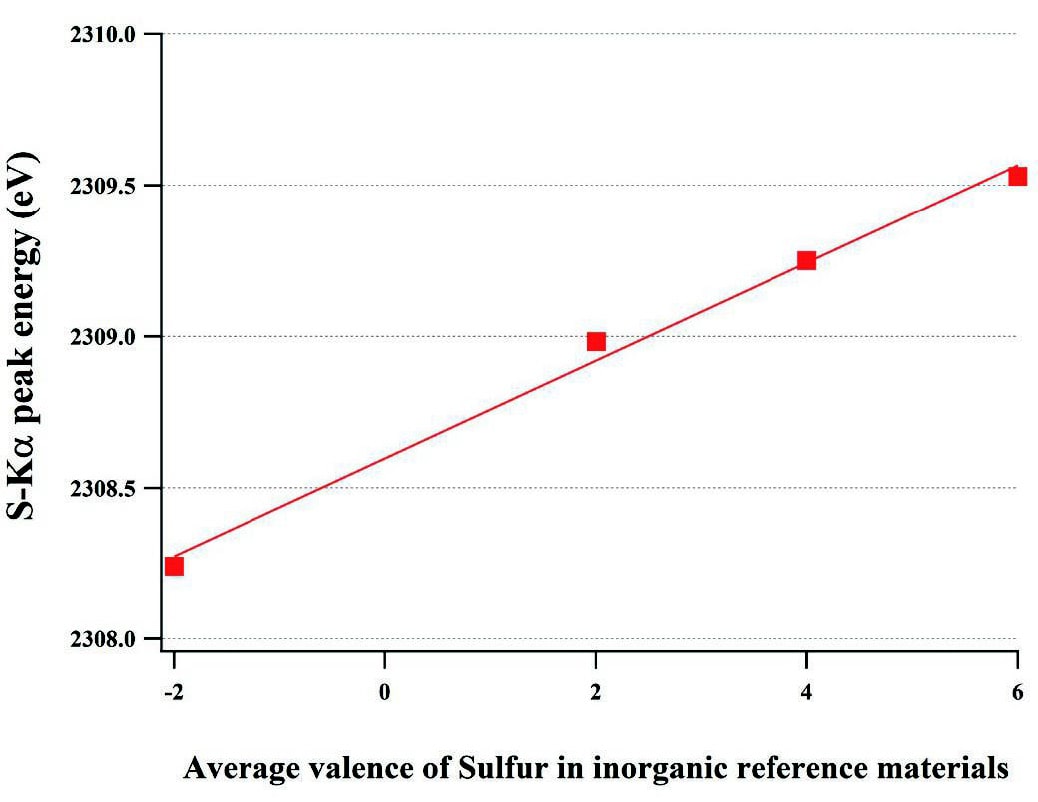 Fig.3 Correlation between the specific valences of sulfur in inorganic reference materials and their S-Kα peak energies and the calibration curve measured by WD-XRF. The size of the points covers the 95% confi dence intervals.
Fig.3 Correlation between the specific valences of sulfur in inorganic reference materials and their S-Kα peak energies and the calibration curve measured by WD-XRF. The size of the points covers the 95% confi dence intervals.3.4. 二つの方法の比較
Table 4に本研究にて提案された化学分析方法およびWD-XRFによるガラス試料中の硫黄の平均価数の比較を示す。これらはよく一致した。
提案された化学分析方法を2つのガラス試料に適用した結果、その硫化物硫黄と硫酸塩硫黄の和が認証値内にあり、また硫黄の平均価数がWD-XRFの結果と一致した。よって新規に提案された化学分析方法の妥当性が検証されたと考えられる。

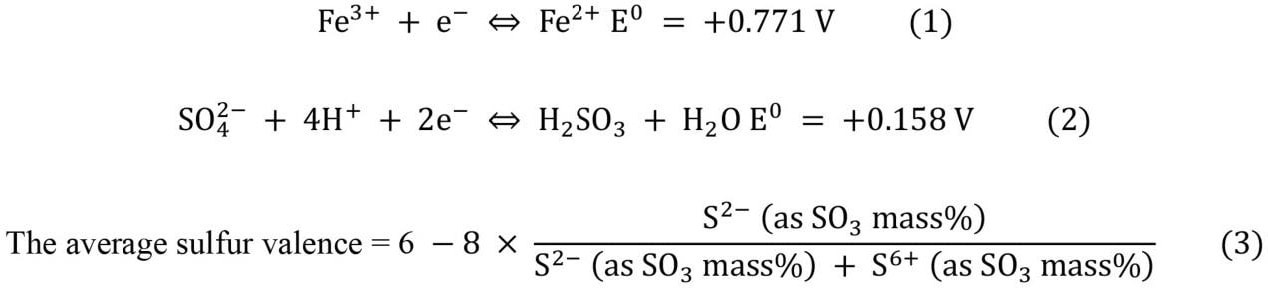
4. 結言
ソーダライムシリケートガラス中の硫化物硫黄と硫酸塩硫黄を一般的に使用されている装置で定量する新しい化学分析方法を開発し、検証した。この方法では、硫化物硫黄を揮散分離法により硫酸塩硫黄と分離した後、残留した硫酸塩硫黄をさらにガラス成分と分離し、それぞれICP-AESにて定量する。この方法は、一般的に使用される装置および機器のみを使用するため、ガラス製造現場の実験室でも実施可能である。本方法を2つのガラス認証物質に適用した。ガラス中の硫化物硫黄と硫酸塩硫黄について、それらの濃度が0.05mass%(as SO3)を超える場合、1%未満の相対標準偏差で定量が可能であった。硫化物硫黄および硫酸塩硫黄の定量限界は、5μg/g未満(as SO3)であった。硫化物硫黄および硫酸塩硫黄の和として計算される全硫黄濃度は、各認証値の範囲内であることを確かめた。さらにこの方法で得られた2つのガラス認証物質の硫黄の平均価数は、WD-XRFで得られたものとよく一致した。以上より、新規に開発された化学分析方法の妥当性が検証された。
謝辞
本論文作成に際し、多大なご指導を賜った京都大学大学院工学研究科材料化学専攻三浦清貴教授、下間靖彦准教授、清水雅弘助教に、ここに謝意を表す。
参考文献
- Y. Arai, M. Inoue, K. Ishikawa, T. Yokote, Y. Kondo, K. Mori, Evolution of the glass light guide plate and its peripheral technologies for large size TV application, in: SID Symposium Digest of Technical Papers, 2017: pp. 1663–1666. https://doi.org/10.1002/sdtp.11964.
- W.A. Wely, Coloured Glasses, Society of Glass Technology, Sheffiled, 1981.
- M.R. Cicconi, A. Veber, D. de Ligny, J. Rocherullé, R. Lebullenger, F. Tessier, Chemical tunability of europium emission in phosphate glasses, J Lumin. 18 3(2017). https://doi.org/10.1016/j.jlumin.2016.11.019.
- G.H. Beall, Design and properties of glass-ceramics, Annual Review of Materials Science. 22(1992). https:// doi.org/10.1146/annurev.ms.22.080192.000515.
- D.B. Dingwell, Redox viscometry of some Fe-bearing silicate melts, American Mineralogist. 76(1991).
- D.B. Dingwell, Shear viscosities of ferrosilicate liquids, American Mineralogist. 74(1989).
- H. Tokunaga, Thermal conductivity measurement of glass melts and its applications, NEW GLASS. 34(2019)14–18.
- R.G.C. Beerkens, Sulphate decomposition and sulphur chemistry in glass melting processes, Glass Technology. 46(2005)39–46.
- R.G.C. Beerkens, K. Kahl, Chemistry of sulphur in soda- lime-silica glass melts, Physics and Chemistry of Glasses. 43(2002)189–198.
- M. CABLE, Kinetics and Mechanisms of Fining Glasses, Journal of the American Ceramic Society. 49(1966). https://doi.org/10.1111/j.1151-2916.1966.tb15412.x.
- F.L. Harding, Effect of base glass composition on amber colour, Glass Technology. 13(1972)43–49.
- D. Brown, R.W. Douglas, “Carbon-suiphur” amber glass, Glass Technology. 6(1965)190–196.
- R.G.C. Beerkens, Amber chromophore formation in sulphur- and iron-containing soda-lime-silica glasses, Glass Science and Technology. 76(2003)166–175.
- E. Paris, G. Giuli, M.R. Carroll, I. Davoli, The valence and speciation of sulfur in glasses by x-ray absorption spectro scopy, Can Mineral. 39(2001)331–339. https://doi.org/ 10.2113/gscanmin.39.2.331.
- L. Backnaes, J. Stelling, H. Behrens, J. Goettlicher, S. Mangold, O. Verheijen, R.G.C. Beerkens, J. Deubener, Dissolution mechanisms of tetravalent sulphur in silicate melts: Evidences from sulphur K edge XANES studies on glasses, Journal of the American Ceramic Society. 91(20 0 8)7 2 1 –7 27. http s:/ / do i.or g/ 1 0. 1111 / j . 1 5 5 1 -2916.2007.02044.
- P.A. Webster, A.K. Lyle, Short Methods for Chemical Analysis of Glass, Journal of the American Ceramic Society. 23(1940)235–241. https://doi.org/10.1111/j.1151-2916.1940. tb14262.x.
- W. Fletcher, Combustion separation techniques in glass analysis, Glastech Ber. 44(1971)462–466.
- Y. Arikawa, T. Ozawa, I. Iwasaki, Determination of total- sulfur in igneous rocks with tin(II)-strong phosphoric acid, BUNSEKI KAGAKU. 21(1972)920–924. https://doi. org/10.2116/bunsekikagaku.21.920.
- T. Yarita, A. Masui, M. Noshiro, Analysis of total- and sulfide- sulfur in silicate glasses by using strong phosph oric acid in combination with ion chromatography, Resear ch Report of Asahi Glass Co., Ltd. 37(1987)37–42.
- E. Toda, Y. Kubota, G. Ichikawa, Determination of trace sulfur by ICP-AES with gas-phase sample introduction technique., BUNSEKI KAGAKU. 41(1992)453–458.https://doi.org/10.2116/bunsekikagaku.41.9_453.
- M. Kawamoto, M. Kagaya, R. Akiyama, Selective determination of trace amounts of total and sulfate-sulfur in glasses, Research Report of Asahi Glass Co., Ltd. 48(1998)11–19.
- A. Makishima, E. Nakamura, Determination of total sulfur at microgram per gram levels in geological materials by oxidation of sulfur into sulfate with in situ generation of bromine using isotope dilution high-resolution ICPMS, Anal Chem. 73(2001)2547–2553. https://doi.org/10.1021/ ac001550i.
- Y. Saijo, Y. Suzuki, R. Akiyama, K. Miura, Determination of sulfur in soda-lime silicate glass by inductively coupled plasma atomic emission spectroscopy following separation using an alumina column, Journal of the Ceramic Society of Japan. 129(2021)54–59. https://doi.org/10.2109/ jcersj2.20185.
- P.J. Potts, A handbook of silicate rock analysis8, in: Blackie, Glasgow, 1987.
- E. Guadagnino, P. Sundberg, D. Brochot, A collaborative study into the determination of boron in glass using x-ray fluorescence(XRF)spectroscopy, Glass Technology: European Journal of Glass Science and Technology PartA. 47(2006)103–111.
- S. Terashima, The rapid determination of total carbon and sulfur in geological materials by combustion and infrared absorption photometry, Anal Chim Acta. 101(1978)25–31. https://doi.org/10.1016/S0003-2670(01)83836-8.
- S. Terashima, Determination of Total Carbon and Sulfur in Fifty ‐ two Geochemical Reference Samples by Combu stion and Infrared Absorption Spectrometry, Geostan dards Newsletter. 12(1988)249–252. https://doi.org/ 10.1111/j.1751-908X.1988.tb00052.x.
- S. Nagashima, M. Yoshida, T. Ozawa, The Determination of Sulfide- and Sulfate-Sulfur in Igneous Rocks with Tin(II)-Strong Phosphoric Acid and Strong Phosphoric Acid, Bull Chem Soc Jpn. 45(1972)3446–3451. https://doi. org/10.1246/bcsj.45.3446.
- J.S. Sieger, Chemical characteristics of float glass surfaces, J Non Cryst Solids. 19(1975)213–220. https://doi.org/ 10.1016/0022-3093(75)90086-1.
- E. Guadagnino, O. Corumluoglu, Indirect determination of sulphide sulphur in glass by flame atomic absorption spectrometry: Report of ICG/TC 2 “chemical durability and analysis,” Glass Technology. 38(1997)179–182.
- T. Sato, Y. Takahashi, K. Yabe, An X-Ray Emission Spec troscopic Investigation of the Chemical Bond of Sulfur. I. The Peak Shift of Kα and the Number of Valence Elec trons of the Sulfur Atom in Compounds , Bull Chem Soc Jpn. 40(1967)298–301. https://doi.org/10.1246/bcsj.40.298.
- A. Faessler, M. Goehring, Röntgenspektrum und Bindungszustand - Die Kα-Fluoreszenzstrahlung des Schwefels, Naturwissenschaften. 39(1952)169–177. https://doi.org/10.1007/BF00589801.
- Y. Gohshi, O. Hirao, I. Suzuki, Chemical State Analyses of Sulfur, Chromium and Tin by High Resolution X-Ray Spectrometry, Advances in X-Ray Analysis. 18(1974) 406–414. https://doi.org/10.1154/s0376030800006911. [34]M.E. Fleet, X. Liu, S.L. Harmer, H.W. Nesbitt, Chemical state of
- M.E. Fleet, X. Liu, S.L. Harmer, H.W. Nesbitt, Chemical state of sulfur in natural and synthetic lazurite by S K-edge xanes and X-ray photoelectron spectroscopy, Can Mineral. 43(2005)1589–1603. https://doi.org/10.2113/ gscanmin.43.5.1589.
- R. Alonso Mori, E. Paris, G. Giuli, S.G. Eeckhout, M. Kavčič,M. Žitnik, K. Bučar, L.G.M. Pettersson, P. Glatzel, Electro nic structure of sulfur studied by X-ray absorption and emission spectroscopy, Anal Chem. 81(2009)6516–6525. https://doi.org/10.1021/ac900970z.
- M.R. Carroll, M.J. Rutherford, Sulfur speciation in hydrous experimental glasses of varying oxydation states: Results from measured wavelength shifts of sulfur X-rays, American Mineralogist. 73(1988).
- M. Wilke, K. Klimm, S.C. Kohn, Spectroscopic studies on sulfur speciation in synthetic and natural glasses, Rev Mineral Geochem. 7 3(2011)41–78. https://doi.org/ 10.2138/rmg.2011.73.3.
- K. Klimm, R.E. Botcharnikov, The determination of sulfate and sulfide species in hydrous silicate glasses using Raman spectroscopy, American Mineralogist. 95(2010) 1574–1579. https://doi.org/10.2138/am.2010.3590.
- Y. Saijo, Y. Suzuki, M. Murata, R. Akiyama, M. Shimizu, Y. Shimotsuma, K. Miura, Separation and determination of sulfide sulfur and sulfate sulfur in soda lime silicate glass, J Non Cryst Solids. 571(2021)121072. https://doi.org/ 10.1016/j.jnoncrysol.2021.121072.
- National Institute of Standards & Technology, Certificate of Analysis Standard Reference Material 1831,(2017). https://tsapps.nist.gov/srmext/certificates/1831.pdf(accessed July 8, 2023).
- The Society of Glass Technology, Certified Reference Material Certificate of Analysis AMBER SODA-LIME- SILICA CONTAINER GLASS SGT 10,(2000). https://cdn.ymaws.com/sgt.org/resource/resmgr/certificatesofanalysis/glass10.pdf(accessed July 8, 2023)